Rapport n° 234 (2020-2021) de Mmes Sonia de LA PROVÔTÉ , sénatrice, Florence LASSARADE , sénatrice, MM. Jean-François ELIAOU, député et Gérard LESEUL, député, fait au nom de l'Office parlementaire d'évaluation des choix scientifiques et technologiques, déposé le 15 décembre 2020
Disponible au format PDF (1,3 Moctet)
|
N°3695 |
N°234 |
|
|
ASSEMBLÉE NATIONALE |
SÉNAT |
|
|
CONSTITUTION DU 4 OCTOBRE 1958 QUINZIÈME LÉGISLATURE |
SESSION ORDINAIRE 2020 - 2021 |
|
|
Enregistré à la présidence de l'Assemblée nationale |
Enregistré à la présidence du Sénat |
|
|
le 15 décembre 2020 |
le 15 décembre 2020 |
RAPPORT
au nom de
L'OFFICE PARLEMENTAIRE D'ÉVALUATION
DES CHOIX SCIENTIFIQUES ET TECHNOLOGIQUES
sur
La stratégie vaccinale contre la Covid-19
PAR
Mmes Sonia de LA PRÔVOTÉ et Florence LASSARADE,
sénatrices, et
MM. Jean-François ELIAOU et Gérard
LESEUL, députés
|
Déposé sur le Bureau de l'Assemblée nationale par M. Cédric VILLANI, Président de l'Office |
Déposé sur le Bureau du Sénat par M. Gérard LONGUET Premier vice-président de l'Office |
Composition de l'Office parlementaire
d'évaluation des choix scientifiques
et technologiques
Président
M. Cédric VILLANI, député
Premier vice-président
M. Gérard LONGUET, sénateur
Vice-présidents
|
M. Didier BAICHÈRE, député |
Mme Sonia de LA PRÔVOTÉ, sénatrice |
|
|
M. Jean-Luc FUGIT, député |
Mme Angèle PRÉVILLE, sénatrice |
|
|
M. Patrick HETZEL, député |
Mme Catherine PROCACCIA, sénatrice |
|
|
DÉPUTÉS |
SÉNATEURS |
|
|
M. Julien AUBERT M. Philippe BOLO Mme Émilie CARIOU M. Jean-François ELIAOU Mme Valéria FAURE-MUNTIAN M. Claude de GANAY M. Thomas GASSILLOUD Mme Anne GENETET M. Pierre HENRIET M. Antoine HERTH M. Jean-Paul LECOQ M. Gérard LESEUL M. Loïc PRUD'HOMME Mme Huguette TIEGNA |
Mme Laure DARCOS Mme Annie DELMONT-KOROPOULIS M. André GUIOL M. Ludovic HAYE M. Olivier HENNO Mme Annick JACQUEMET M. Bernard JOMIER Mme Florence LASSARADE M. Ronan Le GLEUT M. Franck MENONVILLE Mme Michelle MEUNIER M. Pierre OUZOULIAS M. Stéphane PIEDNOIR M. Bruno SIDO |
SOMMAIRE
___
Pages
SAISINE 9
QUELLE STRATÉGIE VACCINALE POUR FAIRE FACE À L'ÉPIDÉMIE DE COVID-19 ? 11
I. AXE 1 - CONNAISSANCES ET INCERTITUDES SCIENTIFIQUES 11
A. QUELQUES ÉLÉMENTS SUR LE VIRUS SARS-COV-2 ET LA MALADIE COVID-19 11
1. La Covid-19, une maladie très inégale 11
2. Une immunité post-infection encore mal connue 12
3. Une évaluation de la séropositivité possible mais peu informative 13
4. Un virus dont l'évolution du génome est à surveiller 13
B. À PROPOS DES PROJETS DE VACCIN 14
1. De nombreux projets, des technologies classiques aux innovantes 14
2. Les plateformes ARN et adénovirus, des outils innovants adaptés aux maladies émergentes 16
3. Une efficacité évaluée sur un unique paramètre, la prévention des formes symptomatiques de la maladie. 17
4. Les effets secondaires associés à la vaccination sous haute surveillance 19
II. AXE 2 : UNE STRATÉGIE DE VACCINATION PROGRESSIVE, DONT LA RÉUSSITE REPOSE SUR UNE BONNE MAÎTRISE DE LA CHAÎNE VACCINALE 22
A. UNE STRATÉGIE DE VACCINATION À LA GOUVERNANCE COMPLEXE 22
1. Une multitude d'intervenants dans la définition de la stratégie vaccinale 22
a. Les acteurs institutionnels classiques mobilisés 22
b. La mise en place d'un dispositif d'expertise en dehors du cadre institutionnel classique 23
2. La mobilisation de nombreux acteurs dans la mise en oeuvre de la vaccination, nécessitant une coordination efficace 24
a. Plusieurs intervenants institutionnels dans la « logistique » de la « vaccination » 24
b. Quel rôle pour la « task force vaccins » ? 25
3. Deux lectures possibles de la multiplication des conseils et comités 25
B. UNE STRATÉGIE DE VACCINATION VOLONTAIRE PROGRESSIVE PAR PHASES 27
1. Une vaccination ciblée 27
2. Une vaccination volontaire : convaincre pour réussir 31
C. DE LA SORTIE D'USINE DES DOSES DE VACCINS AU SUIVI DES PERSONNES VACCINÉES : LE DÉFI DE LA CHAÎNE DE VACCINATION 33
1. Installer une chaîne logistique efficace 33
2. Réussir la première phase 35
3. Élargir progressivement la vaccination à partir de la 2 ème phase en s'appuyant sur l'ensemble des professionnels de santé 36
a. Prendre appui sur le réseau des professionnels de santé de ville 37
b. La mise en place éventuelle de centres de vaccination 38
4. Disposer d'une vaccinosurveillance performante 39
D. DES STRATÉGIES NATIONALES DE VACCINATION DÉCLINÉES DANS UN CADRE EUROPÉEN 40
1. Le cas allemand 40
a. La définition par le Parlement du cadre de la stratégie vaccinale 40
b. Le cadre défini par le gouvernement fédéral sur la base des recommandations de la Stiko 41
2. Le cas espagnol 42
a. La gouvernance de la stratégie vaccinale 42
b. Les grandes lignes de la stratégie vaccinale 43
III. AXE 3 - LA DIMENSION ÉCONOMIQUE, INDUSTRIELLE ET FINANCIÈRE 45
A. DES VACCINS AU MEILLEUR PRIX ET DANS LES MEILLEURS DÉLAIS : UNE STRATÉGIE EUROPÉENNE SUR LA BONNE VOIE MAIS ENCORE PERFECTIBLE 45
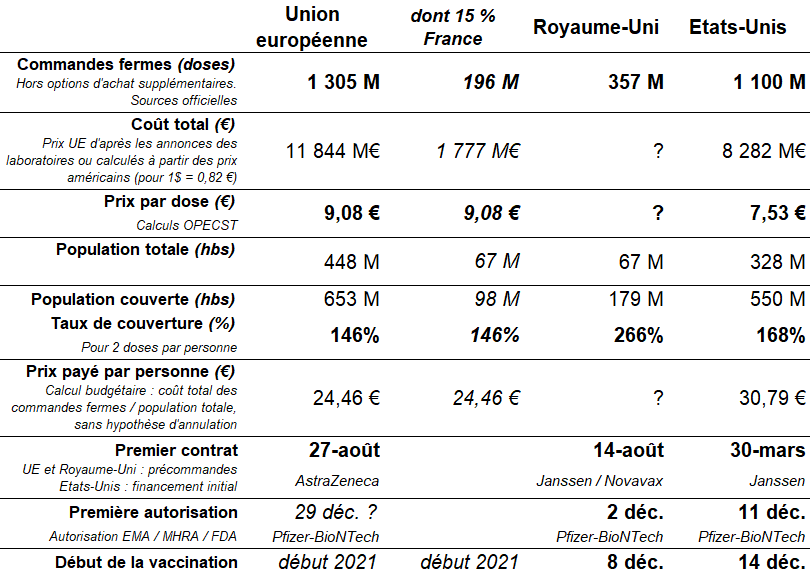
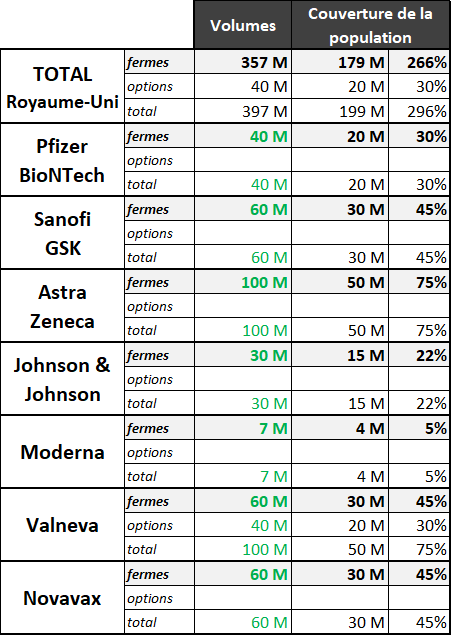
1. L'Union européenne : une stratégie prudente reposant essentiellement sur les volumes 45
a. L'Alliance inclusive et le « choix du collectif » : un progrès majeur pour l'Europe 45
b. La mutualisation des commandes : un facteur important mais pas suffisant 46
c. L'investissement initial, faiblesse principale des pays européens 48
d. Le prix de la sécurité sanitaire ? 50
e. Quelques interrogations de principe sur la stratégie collective 50
2. Le Royaume-Uni : une stratégie risquée, sur le plan financier mais aussi sur le plan médical 51
a. La rapidité, objectif principal d'une stratégie avant tout politique 51
b. Un pari risqué sur le plan financier... 52
c. ...mais aussi risqué sur le plan médical 53
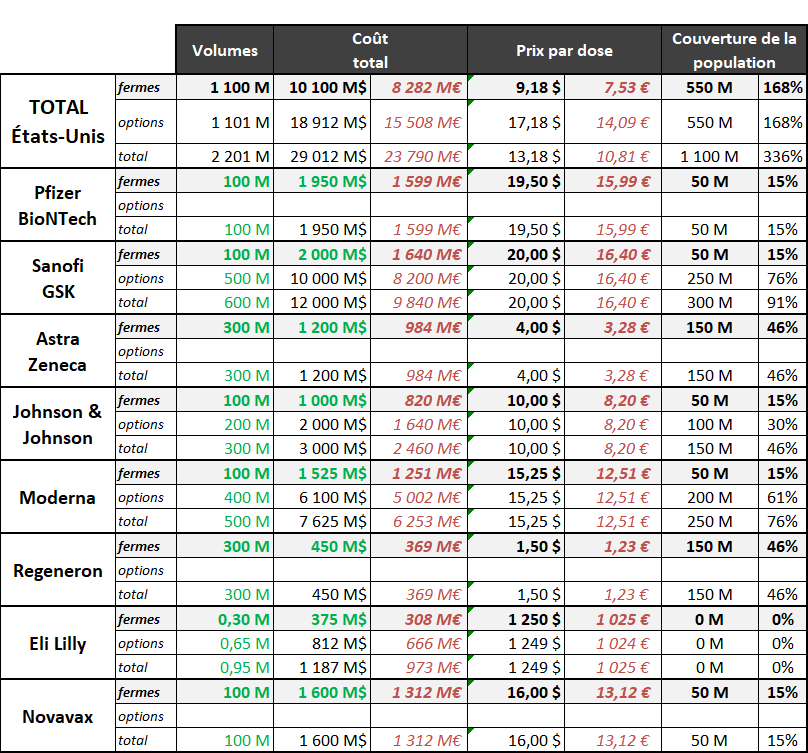
3. Les États-Unis : une stratégie complète dont l'Europe doit faire son ambition 54
a. Des conditions financières avantageuses et une livraison prioritaire 54
b. Payer « cash », payer tôt et payer pour tout : les clés du succès des États-Unis 56
c. Un risque financier mais pas sanitaire 57
d. La BARDA : un modèle à suivre pour l'Union européenne 58
B. STRATÉGIE VACCINALE ET STRATÉGIE ACHATS : DEUX LOGIQUES EN PARTIE AUTONOMES 60
1. La bonne gestion des deniers publics : une exigence valable en temps de crise 60
2. Le prix relatif des différents vaccins : un sujet tabou ? 62
3. Pourquoi commander 200 millions de doses ? 63
4. La question des clauses d'annulation, d'indemnisation et de responsabilité 65
a. Les clauses d'annulation et d'indemnisation liées à l'achat des vaccins 65
b. Les clauses responsabilité en cas de problème médical 66
c. Les causes de confidentialité des contrats 66
C. LA PRODUCTION DE VACCIN EN EUROPE : ENTRE URGENCE MÉDICALE ET SOUVERAINETÉ SANITAIRE 67
1. Pour la Covid-19, une fabrication des vaccins qui semble assurée en Europe 67
2. La dépendance stratégique de l'Europe en matière de médicaments et la question plus large de l'attractivité économique du territoire 68
3. Le lieu de production : une garantie très partielle de souveraineté 70
D. BREVETS, ACCÈS AUX VACCINS ET COOPÉRATION INTERNATIONALE : UNE ÉQUATION ENCORE NON RÉSOLUE 72
1. Les brevets, moteur de l'innovation ou obstacle à l'accès aux vaccins ? 72
a. L'enjeu des brevets pour l'industrie pharmaceutique 72
b. Les brevets remis en cause par de nouveaux entrants 72
c. Vers des vaccins gratuits pour tous ? 73
2. L'initiative internationale COVAX : une réponse partielle au problème de l'accès aux vaccins 74
a. Un objectif de distribution plus équitable des vaccins 74
b. Des progrès encourageants 74
c. Des objectifs restant à concrétiser 75
IV. AXE 4 : COVID-19 : DÉFIANCE DE LA POPULATION, DÉFI DE LA VACCINATION 77
A. UN DÉFICIT DE CONFIANCE RENFORÇANT L'HÉSITATION VACCINALE 77
1. La problématique classique des résistances à la vaccination 77
2. Le continuum de l'hésitation vaccinale : du refus de toute vaccination à la résistance par prudence 78
3. Des difficultés accrues en 2020 avec une nouvelle ère du soupçon liée à la crise de la Covid-19 81
B. LA STRATÉGIE DE VACCINATION EST SOUMISE À UN IMPÉRATIF DE TRANSPARENCE 84
1. Restaurer la confiance par la transparence 84
2. Valoriser l'éthique de responsabilité et l'éthique en santé publique 88
3. Réaffirmer la démocratie sanitaire et renforcer la pharmacovigilance 92
RECOMMANDATIONS 97
EXAMEN DU RAPPORT PAR L'OFFICE 101
LISTE DES PERSONNES ENTENDUES PAR LES RAPPORTEURS 113
SAISINE
QUELLE STRATÉGIE
VACCINALE POUR FAIRE FACE
À L'ÉPIDÉMIE DE
COVID-19 ?
I. AXE 1 - CONNAISSANCES ET INCERTITUDES SCIENTIFIQUES
A. QUELQUES ÉLÉMENTS SUR LE VIRUS SARS-COV-2 ET LA MALADIE COVID-19
1. La Covid-19, une maladie très inégale
La Covid-19 est très hétérogène d'une personne à l'autre, puisque de nombreuses personnes ne développent pas de symptômes suite à l'infection (formes asymptomatiques), en développent peu (formes paucisymptomatiques), font une forme sévère, voire en décèdent. Ces formes sévères se manifestent par une pneumopathie, qui peut nécessiter une hospitalisation et une oxygénation artificielle. Les cas les plus graves demandent un placement en réanimation. L'observation des cas graves indique que ce n'est pas le virus en lui-même qui provoque l'aggravation de la maladie, mais une réaction anormale du système immunitaire, qui provoque une hyper-inflammation systémique et peut conduire à une défaillance multi-organes et au décès. De plus, de nombreuses personnes subissent encore les conséquences de la maladie plusieurs mois après la fin de la phase infectieuse dans ce qui est communément appelé le Covid-long.
La mortalité globale se situerait aux alentours de 0,5 % en France, mais cette donnée pourrait être surestimée, dans la mesure où une partie des cas d'infection ne sont pas détectés, pour les formes les plus légères. La mortalité est en réalité très variable selon l'âge et certains facteurs de risque. Dans son dernier bulletin épidémiologique, Santé publique France indique notamment que 93 % des décès avec mention de Covid-19 sont survenus en France chez des personnes âgées de plus de 65 ans. En audition, Jean-Daniel Lelièvre, virologue et membre de la Commission technique des vaccinations, a rapporté que des études internationales ont montré que l'âge est le principal facteur de risque de faire une forme sévère de la Covid-19 et d'en décéder, loin devant les autres facteurs de risque que sont l'obésité, l'hypertension, le diabète, etc. L'une d'elle a analysé les données de mortalité de plusieurs pays afin d'estimer un taux de létalité moyen par tranche d'âge sur la base d'études de séroprévalence 1 ( * ) . Si ce taux est inférieur à 0,1 % en dessous de 45 ans, il s'élève à 0,3 % pour les 55-59 ans, 1,7 % pour les 70-74 ans et il est de 8,3 % pour les plus de 80 ans. Ces études ont permis de révéler l'importance du sexe comme facteur de risque : les hommes âgés de plus de 80 ans ont un risque presque doublé par rapport à celui des femmes de la même tranche d'âge.
2. Une immunité post-infection encore mal connue
L'infection naturelle par le SARS-CoV-2 induit une réponse immunitaire chez les sujets atteints qui est étudiée par le biais d'études séro-épidémiologiques (en population) ainsi que par l'expérimentation animale. Des suivis de cohortes de population infectées pendant la première vague de circulation du virus ont été mises en place en France, notamment sous l'égide de l'Institut Pasteur. Les différents travaux conduits dans le monde ne permettent cependant pas d'avoir une connaissance complète de cette immunité, dans la mesure où sont souvent détectés des anticorps reconnaissant le virus, sans pour autant systématiquement vérifier leur capacité à empêcher l'infection par le virus (anticorps neutralisants ou non). De plus, la place de l'autre composante de l'immunité adaptative, l'immunité cellulaire, ainsi que son rôle protecteur suspecté doivent être confirmés. Finalement, le virus n'ayant infecté les populations humaines de manière massive que depuis quelques mois, le recul sur l'immunité atteint seulement les 9 mois et l'immunité de long terme (plusieurs années) est inconnue.
Ces travaux ont mis au jour le fait que la réponse immunitaire adaptative est inégale, à l'image de la gravité des symptômes de la maladie : les sujets développant une forme asymptomatique ont des titres moins élevés d'anticorps que les sujets ayant fait une forme sévère de la maladie. Néanmoins, un moindre titre d'anticorps n'implique pas forcément une moins bonne protection contre le virus, dans la mesure où l'immunité cellulaire est probablement protectrice. Une déficience dans le développement d'une immunité cellulaire contre le virus est justement observée chez une partie des patients atteints d'une forme grave 2 ( * ) . La composante innée de l'immunité serait également clef dans la capacité de l'organisme à se débarrasser du virus.
Le recul sur cette immunité montre que des anticorps sont détectés chez les sujets infectés au moins 6 à 9 mois après infection, à des niveaux qui demeurent hétérogènes 3 ( * ) .
3. Une évaluation de la séropositivité possible mais peu informative
Les tests sérologiques, qui permettent de mettre en évidence la présence d'anticorps dirigés contre le virus, sont de qualité variable et ne permettent pas toujours une bonne évaluation du statut sérologique. Les tests de type TROD (test rapide d'orientation diagnostique), réalisables en pharmacie, ont une sensibilité faible et ne permettent pas de quantifier le titre d'anticorps. Les tests utilisés en laboratoire pour le suivi séro-épidémiologique sont beaucoup plus sensibles, mais ne permettent pas non plus de conclure sur la capacité des anticorps à induire une protection - caractère neutralisant ou non. Cette capacité est vérifiée par l'utilisation des anticorps sur des cellules en culture exposées au virus, un test qui est peu adapté à une utilisation à grande échelle.
Comme cela a été précédemment évoqué, l'évaluation du titre d'anticorps et de leur pouvoir neutralisant ne permet pas de déduire directement si un sujet est protégé contre une réinfection dans la mesure où d'autres composantes de l'immunité tiennent un rôle important. Des travaux suggèrent que c'est la réunion du bon fonctionnement de ces différentes composantes qui est protectrice vis-à-vis des formes sévères de la Covid-19 4 ( * ) .
4. Un virus dont l'évolution du génome est à surveiller
Le SARS-CoV-2 est un virus à ARN et son génome est susceptible d'évoluer. De nombreuses mutations sont déjà survenues mais la seule mutation majeure est celle qui est dénommée D614G et qui a dominé l'épidémie européenne dès la première vague. Depuis, aucune mutation n'a affecté le domaine de la protéine de spicule interagissant avec le récepteur cellulaire humain par l'intermédiaire duquel le virus infecte les cellules 5 ( * ) .
Une mutation, très médiatisée car elle aurait pu rendre moins efficace la neutralisation du virus par les anticorps de l'organisme, est apparue aux Pays-Bas et au Danemark, mais ailleurs également, et n'a pas pris le pas sur les virus actuellement en circulation.
Le génome des virus en circulation est régulièrement séquencé et scruté avec une vive attention pour détecter toute mutation qui pourrait avoir des répercussions sur la virulence ou l'infectiosité du virus et qui pourrait diminuer la capacité du système immunitaire à l'empêcher de réinfecter les individus déjà exposés ou vaccinés. Le Centre national de référence des virus des infections respiratoires, dirigé par Sylvie van der Werf, est notamment chargé de ce suivi, en collaboration avec un groupe de travail de l'Organisation mondiale de la santé. Le Centre n'étant plus en charge de l'activité diagnostique, comme cela a été le cas au début de la première vague en France, il dépend du partage des prélèvements effectués par les hôpitaux pour ce séquençage. Il est important que le séquençage du génome viral soit réalisé fréquemment, qu'il permette d'échantillonner tout le territoire, et que les séquences soient partagées avec la communauté scientifique internationale pour pouvoir identifier rapidement la survenue de mutations signifiantes. De l'avis de Sylvie van der Werf, il sera d'autant plus important de pouvoir séquencer le virus chez des personnes vaccinées qui développent cependant secondairement une infection.
En bref :
Les premiers résultats de suivi des marqueurs immunitaires dans les populations infectées semblent indiquer que l'infection naturelle pourrait conférer une protection de moyen terme (6 à 9 mois). Le faible taux de réinfection, même s'il est certainement sous-estimé, va dans ce sens.
Il est aujourd'hui impossible d'évaluer avec certitude l'état de protection d'une personne contre une réinfection par le SARS-CoV-2, encore moins à grande échelle. L'établissement d'un certificat d'immunité sur la base de la mesure du titre d'anticorps circulants n'est pas pertinent.
Recommandation Il est pertinent, au plan sanitaire, de proposer la vaccination aux personnes ayant déjà contracté la COVID-19. Cependant, dans un contexte de limitation des doses de vaccin, les personnes disposant d'un résultat de RT-PCR positif pourraient être écartées des deux premières phases de vaccination définies par la Haute autorité de santé, même si cela pourrait causer des difficultés logistiques.
Recommandation Le virus et son épidémiologie doivent être surveillés pour pouvoir rapidement identifier toute mutation signifiante. Les efforts de séquençage du génome doivent continuer, tout particulièrement si des cas d'échappement vaccinal surviennent.
B. À PROPOS DES PROJETS DE VACCIN
1. De nombreux projets, des technologies classiques aux innovantes
De très nombreux projets de vaccins sont actuellement à l'étude dans le monde, dont 58 sont en cours d'essais cliniques, c'est-à-dire testés chez l'homme. Ces projets reposent sur des technologies vaccinales (ou plateformes vaccinales) différentes, des plus classiques, comme une version inactivée du virus, aux plus innovantes.
Les projets les plus avancés (en phase 3 d'essai clinique ou bénéficiant déjà d'autorisation anticipée d'utilisation) sont les suivants :
• Vaccins à ARN (Pfizer/BioNTech et Moderna) : ils consistent à inoculer au patient un ARN messager, qui est un produit intermédiaire de l'expression du génome, codant pour la protéine de spicule du virus, complète ou réduite à la zone d'interaction avec le récepteur cellulaire humain. Cet ARN messager pénètre quelques cellules, dont la machinerie exprime alors transitoirement la protéine virale (de l'ordre de quelques jours). Les protéines virales ainsi produites sont reconnues par le système immunitaire de l'individu, entraînant une réponse immunitaire ;
• Vaccins à vecteur adénovirus (AstraZeneca/Université d'Oxford, Gamaleya Research Institute (Sputnik V), Johnson&Johnson, CanSinoBio) : comme pour les virus à ARN, ce sont les cellules humaines qui expriment la protéine virale et permettent la reconnaissance par le système immunitaire. Cependant, dans ce cas, la matrice qui permet cette synthèse est une séquence synthétique d'ADN correspondant à la protéine virale. Cette séquence d'ADN est véhiculée jusqu'aux cellules par l'intermédiaire d'un virus bénin pour l'homme, de la famille des adénovirus. Ce virus n'ayant pas la capacité de se répliquer dans l'organisme, le vaccin peut convenir aux personnes immunodéprimées ;
• Vaccins à base d'antigène ou vaccins sous-unitaires (Novavax, Medicago/Gsk, Zfsw) : ces vaccins sont composés de la protéine virale de spicule synthétique, complète ou tronquée, éventuellement associée à un adjuvant pour amplifier la réponse immunitaire ;
• Vaccins à base de virus inactivé (Sinopharm, Sinovac, Bharat Biotech) : le virus SARS-CoV-2, dans une forme inactivée, donc non virulente, est directement inoculé.
Le vaccin Pfizer/BioNTech a déjà commencé à être commercialisé suite à l'obtention d'autorisations de mise sur le marché dans plusieurs pays, comme le Canada et Arabie Saoudite. Son usage a été également été autorisé dans un contexte d'urgence aux États-Unis et au Royaume-Uni, et devrait l'être en début d'année 2021 au sein de l'Union européenne.
Les vaccins CanSinoBIO et Sinovac ont une reçu une autorisation pour un usage précoce et limité en Chine, le vaccin Sinopharm a été autorisé en Arabie Saoudite et un usage précoce du vaccin de l'Institut Galameya (Sputnik V) a été approuvé en Russie.
2. Les plateformes ARN et adénovirus, des outils innovants adaptés aux maladies émergentes
Les vaccins à ARN, dont ceux de Pfizer/BioNTech et Moderna sont les plus avancés, ainsi que les vaccins à adénovirus, développés notamment par AstraZeneca/Université d'Oxford et l'Institut Gamaleya en Russie, sont des plateformes vaccinales qui étaient l'objet de projets de vaccins mais qui n'avaient jusqu'ici jamais obtenu d'autorisation de mise sur le marché.
Ces plateformes consistent toutes deux à utiliser des cellules humaines, notamment les cellules dendritiques, pour faire exprimer un antigène viral (ici, la protéine de spicule, complète ou tronquée), reconnu ensuite par le système immunitaire. Les vaccins à ARN transmettent un ARN qui code pour l'antigène viral tandis que les vaccins à adénovirus transmettent une séquence d'ADN codant pour l'antigène.
Dans le premier cas, l'ARN est encapsulé dans des nanoparticules lipidiques dont le rôle est double : rendre invisible l'ARN au système immunitaire, car il provoquerait alors une forte réaction immunitaire contre lui-même et non contre l'antigène viral, et faciliter la pénétration dans les cellules humaines. La séquence d'ARN est construite de manière différente d'une séquence d'ARN messager naturelle de façon à augmenter sa stabilité et à diminuer sa visibilité du système immunitaire.
Dans le deuxième cas, la séquence d'ADN est directement transmise par le virus vecteur, l'adénovirus. Tous les virus ont cette capacité à injecter un matériel génétique dans des cellules hôtes, puisqu'ils dépendent de la machinerie cellulaire de ces cellules pour se répliquer. L'adénovirus est utilisé pour son innocuité pour l'espèce humaine. Mais de nombreux adénovirus circulent dans le monde, aussi, les laboratoires ont opté pour des stratégies différentes afin de limiter le risque d'immunité contre le vecteur.
Ce phénomène est susceptible de diminuer l'efficacité des vaccins, car le système immunitaire d'une personne déjà exposée à cet adénovirus pourrait détruire le vecteur avant qu'il ne transmette la séquence d'intérêt à ses cellules. L'alliance AstraZeneca/Université d'Oxford a ainsi choisi une souche d'adénovirus de chimpanzé quand d'autres ont sélectionné des souches que l'on trouve chez l'homme mais très rarement. La prévalence des souches d'adénovirus pouvant varier d'une région du monde à l'autre, les vaccins à adénovirus pourraient être pertinents dans une région et moins dans une autre (la circulation des adénovirus est plus intense en Afrique et en Asie qu'en Europe). Pour réduire le risque d'une baisse d'efficacité entre la première et la seconde dose de vaccin, due à l'immunité qui se développerait contre le vecteur après la première injection, l'Institut Gamaleya a opté pour une stratégie consistant à utiliser un adénovirus différent pour la seconde injection.
Ces deux plateformes vaccinales avaient déjà été mises en places pour d'autres maladies infectieuses ainsi que pour des traitements thérapeutiques, les vaccins à ARN étant l'objet de nombreux projets de traitement de cancer. Elles étaient donc opérationnelles dans la mesure où seule la séquence codant pour l'antigène viral change, d'un projet à l'autre. De plus, les travaux réalisés sur les précédents coronavirus pandémiques avaient permis d'identifier l'antigène viral à cibler. C'est ainsi que les laboratoires BioNTech, Moderna et l'Université d'Oxford ont pu commencer à travailler sur un projet de vaccin dès que la séquence du virus a été connue.
L'avantage de ces plateformes réside également dans la possibilité d'adapter rapidement le vaccin si le virus devait connaître des mutations diminuant l'efficacité des vaccins actuellement développés.
3. Une efficacité évaluée sur un unique paramètre, la prévention des formes symptomatiques de la maladie.
Plusieurs laboratoires pharmaceutiques et instituts ont annoncé des résultats de phase 3 encourageants quant à l'efficacité des vaccins à protéger contre des formes symptomatiques de la Covid-19, seul critère testé lors de ces études. Les données d'efficacité publiées par l'alliance Pfizer/BioNTech sont bien meilleures qu'anticipées (95 % d'efficacité), car les projets de vaccins à ARN développés jusqu'ici pour les maladies infectieuses n'avaient pas été très prometteurs, selon Bernard Verrier, spécialiste des vaccins à ARN. De l'avis d'Olivier Schwartz, virologue et directeur scientifique de l'Institut Pasteur, cela tiendrait à la propriété de ce coronavirus d'être facilement neutralisé.
Les résultats détaillés des phases 3 commencent à être publiées sous la forme d'articles scientifiques dans des revues spécialisées, avec examen par les pairs. Les données de phase 3 du vaccin Pfizer/BioNTech ont été publiées dans le New England Journal of Medicine 6 ( * ) . L'efficacité du vaccin en population générale est de 95 % après l'injection des deux doses et de 52 % après une seule dose. Il est indiqué que l'efficacité est constante lorsque sont considérés des sous-groupes établis en fonction de l'âge, du sexe, de l'ethnicité, d'une obésité et de la présence de maladies sous-jacentes. L'efficacité est estimée à 95,6 % dans la tranche d'âge 16-55 ans, 93,7 % pour la tranche 56-65 ans, et 94,7 % pour la tranche 66-75 ans. L'efficacité n'a pu être établie pour les plus de 75 ans du fait d'effectifs trop faibles. Lors de son audition, Alain Fischer, professeur d'immunologie, a marqué son accord avec la stratégie de la Haute Autorité de santé, qui est de vacciner également les plus de 75 ans, car jugés très à risque.
Dans un communiqué de presse 7 ( * ) faisant état de résultats intermédiaires de phase 3, Moderna a indiqué que son vaccin est efficace à 94 % contre les formes symptomatiques de la Covid-19 et à 100 % contre les formes sévères.
L'alliance AstraZeneca/Université d'Oxford a annoncé des données d'efficacité intermédiaires moins bonnes, publiée dans la revue The Lancet 8 ( * ) . Suite à une erreur de dosage pour une partie des participants à l'essai, deux groupes ont été formés : le premier est celui qui a reçu les deux doses complètes, le deuxième, celui qui a reçu une demie-dose lors de la première injection. L'efficacité du vaccin a été de 62 % dans le premier groupe et de 90 % dans le deuxième. La différence d'efficacité entre les deux groupes interroge et doit être clarifiée. S'il n'est pas impossible que doubler la dose entre les deux injections permette d'atteindre une meilleure efficacité, il doit être remarqué que le deuxième groupe n'était composé que d'individus dans la tranche d'âge 18-55 ans, quand 21 % des effectifs du premier groupe correspondaient à des personnes âgées de plus de 56 ans.
La vaccination des personnes âgées est un défi, comme c'est le cas pour la vaccination contre la grippe, car le système immunitaire sénescent réagit moins bien à la vaccination. Il est possible que certaines plateformes vaccinales offrent une meilleure protection des personnes âgées. Si tel était le cas, elles pourraient être privilégiées pour ce public. Dans l'hypothèse où, d'ici quelques mois, plusieurs vaccins bénéficieront d'une autorisation de mise sur le marché, des vaccins moins efficaces pour les personnes âgées, tel que cela semble être le cas pour le projet de vaccin de type antigène Sanofi/Gsk, pourraient être prescrit en priorité aux personnes peu âgées.
Il n'y a pour l'instant pas suffisamment de recul sur l'efficacité de la vaccination pour prévoir la durée de la protection conférée par les vaccins. Des études de long terme sont nécessaires pour l'évaluer et, en fonction de cette durée et de la circulation du virus, décider de la nécessité de revacciner régulièrement ou non.
Les vaccins n'ayant été testés que pour leur capacité à empêcher la survenue de formes symptomatiques, leur action sur le portage du virus est inconnue. La logique qui prévaut, en matière de vaccination, est celle de la construction d'une immunité collective, qui protège ceux qui ne sont pas vaccinés. Mais il ne peut y avoir d'immunité collective que lorsque la vaccination empêche la transmission du virus et quand il n'existe pas de réservoir non humain à celui-ci. Quand ce n'est pas le cas, la protection conférée par les vaccins est individuelle. Le vaccin contre le tétanos, par exemple, n'assure qu'une protection individuelle car la bactérie qui en est responsable est présente dans le sol et ne se transmet pas d'homme à homme. Un autre exemple est celui du vaccin contre la poliomyélite qui est utilisé en Europe : il immunise l'organisme mais n'empêche pas le virus de se multiplier dans les muqueuses, alors que le vaccin utilisé dans des pays où le virus sauvage circule induit une immunisation au niveau des muqueuses et empêche le portage.
La possibilité que les vaccins contre la Covid-19 soient stérilisants et qu'ils empêchent également la transmission du virus n'a pas été testée dans les essais de phase 3, car ils nécessiteraient un dépistage régulier par RT-PCR de tout ou partie des participants à l'essai pour détecter les formes asymptomatiques et les cas d'infection secondaire. Des essais cliniques vont démarrer en France avec l'initiative Covireivac, dirigée par Odile Launay, pour mieux étudier la réponse immunitaire post-vaccinale, pour les vaccins d'AstraZeneca/Université d'Oxford, de Jonhson & Johnson et de Moderna. Le suivi de la réponse immunitaire et de ses différentes composantes permettra de mieux évaluer l'immunité muqueuse conférée par les vaccins et donc leur capacité à empêcher le portage et la propagation du virus.
L'observation de la réponse immunitaire développée par des primates dans des essais réalisés avec le vaccin Pfizer/BioNTech et le vaccin Moderna et leur exposition post-vaccinale au virus a montré que ces vaccins protègent les voies respiratoires, ce qui laisse présager à tout le moins une certaine efficacité de ces vaccins sur la transmission chez l'homme également 9 ( * ) .
4. Les effets secondaires associés à la vaccination sous haute surveillance
Les vaccins, comme tout médicament, ne sont pas dénués d'effets secondaires, mais ceux-ci sont très scrutés dans le cas des vaccins puisqu'ils sont administrés à des personnes saines, non malades. Les premiers résultats publiés font état de survenue d'effets secondaires tels que l'apparition d'une fièvre transitoire, de douleur au point d'injection, de douleurs articulaires, etc. chez de nombreux participants à l'étude 10 ( * ) . Ces effets secondaires bénins sont classiques des vaccins. Il semblerait qu'ils soient plus fréquents pour le vaccin Pfizer/BioNTech, probablement du fait de la réactogénicité de celui-ci. Dans la mesure où une fièvre peut légitimement inquiéter, les scientifiques, les médecins et les spécialistes de l'hésitation vaccinale insistent sur la nécessité de bien prévenir les personnes vaccinées de ces effets secondaires, au risque qu'une partie d'entre elle ne réalise pas la deuxième injection et ne soit pas protégée du virus. De l'avis d'Alain Fischer, ces effets pourraient éventuellement être prévenus par une prise anticipée de paracetamol.
S'agissant du risque d'allergie grave, observé pour tout vaccin et l'ordre d'une personne sur cent mille, il est également susceptible de subvenir. La survenue de deux cas de réaction allergique grave au premier jour de la vaccination au Royaume-Uni interpelle, selon Alain Fischer. Les autorités sanitaires britanniques ont, en conséquence, recommandé de ne pas vacciner les personnes susceptibles de faire des réactions allergiques graves (typiquement, les personnes qui ont en permanence de l'adrénaline injectable). Cette recommandation fera probablement partie des précautions d'usage associées à l'avis de l'Agence européenne du médicament. C'est le suivi de pharmacovigilance assuré par l'Agence nationale de sécurité du médicament (ANSM) qui permettra de déterminer si le risque allergique est supérieur pour ce type de vaccin que pour les autres.
Concernant d'autres effets secondaires graves qui pourraient être dus à la vaccination, il est difficile de conclure, car il n'y a pas de recul sur la tolérance de ces vaccins à long terme (plus de 3 mois) et sur un grand nombre de personnes. Les scientifiques n'excluent pas le risque que la vaccination pourrait développer des manifestations auto-immunes. Des cas de syndrome de Guillain-Barré, qui se développe après une infection ou une vaccination, surviendront certainement selon Arnaud Fontanet, qui note toutefois que pour les vaccins tels que celui contre la rougeole, le risque de survenue d'un syndrome de Guillain-Barré suite à la vaccination est plus faible qu'après la maladie naturelle. Les scientifiques notent que le risque de manifestations auto-immunes est quasi nul chez la population âgée dont le système immunitaire est vieillissant. Ainsi, pour cette tranche d'âge très à risque de forme grave de Covid-19, la balance bénéfice-risque est largement en faveur du vaccin, en ce qui concerne un vaccin tel que celui de Pfizer/BioNTech.
En bref :
Moins d'un après le début de la pandémie, les vaccins commencent à être déployés. D'autres projets, moins avancés, arriveront au fur-à-mesure de l'année 2021.
Des plateformes vaccinales adaptées à la production rapide de vaccins dans un contexte de crise pandémique ont permis la production extrêmement rapide de vaccins, qui pourraient être modifiés si le virus changeait.
Si la capacité des vaccins à empêcher les formes graves de survenir a été démontrée, leur capacité d'empêcher la transmission est incertaine, mais probable. Le vaccin a donc un intérêt individuel certain, quand l'intérêt collectif l'est moins.
Le vaccin Pfizer/BioNTech a montré une efficacité aussi bonne chez les personnes âgées qu'en population générale, alors que cette population répond souvent moins bien aux vaccins et qu'elle est celle qui subit le plus les conséquences de la pandémie en termes de morbidité et de mortalité.
La durée de la protection conférée par les vaccins est inconnue.
Recommandation Le risque d'effets secondaires bénins, plus fréquents qu'habituellement, doit absolument être expliqué aux personnes recevant le vaccin, au risque qu'une partie d'entre elles ne reçoive pas la seconde injection.
Recommandation La balance bénéfices-risques est largement en faveur de la vaccination par un vaccin tel que celui proposé par l'alliance Pfizer/BioNTech pour la population âgée. Les scientifiques pointent l'absence de recul sur d'éventuels effets indésirables à long terme en population générale, de type manifestations auto-immunes, que la population âgée est peu susceptible de développer.
II. AXE 2 : UNE STRATÉGIE DE VACCINATION PROGRESSIVE, DONT LA RÉUSSITE REPOSE SUR UNE BONNE MAÎTRISE DE LA CHAÎNE VACCINALE
A. UNE STRATÉGIE DE VACCINATION À LA GOUVERNANCE COMPLEXE
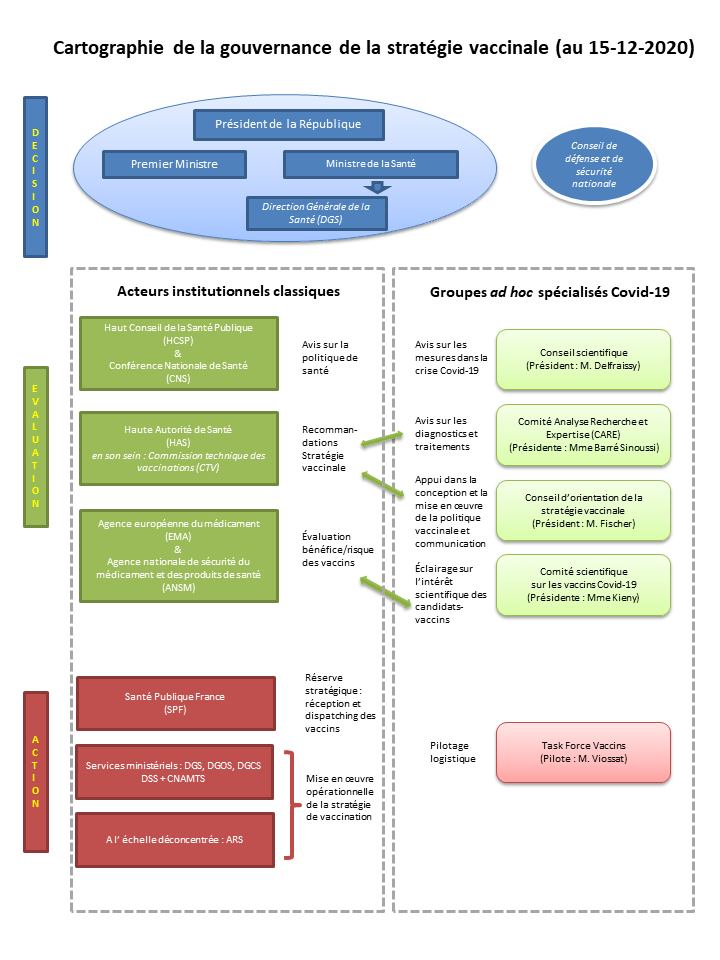
1. Une multitude d'intervenants dans la définition de la stratégie vaccinale
Les choix politiques in fine en matière de stratégie vaccinale relèvent de l'exécutif. Pour réaliser ses choix, l'exécutif a décidé de s'appuyer à, la fois sur les acteurs institutionnels classiques de la politique de santé publique et sur un ensemble de comités d'experts ad hoc . On peut noter le rôle éminent dans la prise de décision joué par le Conseil de défense et de sécurité nationale (CDSN), initialement centré sur les questions de défense et de sécurité, qui se réunit chaque semaine, et qui est désormais réuni régulièrement sur les questions sanitaires.
a. Les acteurs institutionnels classiques mobilisés
La Haute Autorité de Santé (HAS) 11 ( * ) a de nombreuses missions 12 ( * ) qui tournent autour de l'évaluation du service rendu par les produits de santé, la certification des établissements de santé et l'accréditation de certains professionnels. La loi prévoit qu'elle est également chargée de « participer à l'élaboration de la politique de vaccination et émettre des recommandations vaccinales ». Elle est dirigée par un collège et comprend 8 commissions 13 ( * ) , dont la commission technique des vaccinations (CTV) 14 ( * ) . Exerçant sa compétence de conseil scientifique des pouvoirs publics en matière de vaccination, elle avait été saisie le 20 octobre 2020 par le directeur général de la santé (DGS) et a rendu le 30 novembre 2020 un rapport contenant des « recommandations préliminaires sur la stratégie de priorisation des populations à vacciner » contre le SARS-Cov-2 15 ( * ) (cf. infra).
L'Agence nationale de sécurité du médicament et des produits de santé (ANSM) 16 ( * ) a pour mission d'évaluer l'efficacité et la sécurité des médicaments et produits biologiques, notamment des vaccins 17 ( * ) . Cette mission s'exerce dans le cadre du système européen d'évaluation des médicaments et produits de santé conditionnant l'accès au marché, qui repose sur l'Agence européenne du médicament (EMA). Pour les vaccins contre le SARS-Cov-2, les dossiers de demande d'autorisation des candidats-vaccins préparés par les laboratoires sont déposés à l'échelle européenne auprès de l'EMA, qui effectue l'évaluation réglementaire avant que la Commission européenne prenne la décision d'autoriser ou pas l'accès au marché du vaccin sur tout le territoire de l'Union. Le candidat-vaccin de Pfizer-BioNTech a fait l'objet d'une demande d'autorisation de mise sur le marché (AMM) déposée le 1 er décembre 2020 auprès de l'EMA qui rendra son évaluation le 29 décembre 2020. L'ANSM est associée aux travaux d'évaluation. Les autres candidats-vaccins devraient suivre la même procédure.
Outre l'évaluation des médicaments, l'ANSM organise le système d'inspection des établissements de production et de distribution des médicaments et pilote la pharmacovigilance, en s'appuyant sur un réseau de 31 centres régionaux de pharmacovigilance (CRPV) qui recueillent les déclarations d'effets indésirables. Elle interviendra donc en matière de vaccinovigilance (surveillance des effets indésirables) et de vaccinosurveillance (évaluation plus globale du processus de vaccination).
Le Haut Conseil de la Santé Publique (HCSP) 18 ( * ) et la Conférence nationale de santé (CNS) 19 ( * ) ont également une mission consultative. Le HCSP a produit des avis nombreux en lien avec l'épidémie de Covid, mais pas encore sur la question de la vaccination. La CNS, appelée aussi « Parlement de la Santé », est une instance de concertation et de débats qui n'a pas encore produit d'avis sur la vaccination.
b. La mise en place d'un dispositif d'expertise en dehors du cadre institutionnel classique
Depuis le début de la crise de la Covid-19, des structures ad hoc s'ajoutent aux nombreuses institutions existant, afin de mobiliser largement les experts dans l'optique d'éclairer au mieux la décision publique :
- le Conseil scientifique , présidé par le Pr Jean-François Delfraissy, a été mis en place dès le mois de mars 2020 et formule des avis publics destinés à orienter la prise de décision de l'exécutif sur de nombreux aspects : situation épidémique, mesures barrières, confinement, etc. ;
- le Comité Analyse Recherche et Expertise (CARE) , présidé par Françoise Barré-Sinoussi, a été lui aussi mis en place fin mars 2020 afin d'éclairer le Gouvernement sur les diagnostics et les traitements. Il semble ne pas avoir d'activité eu égard aux questions de vaccination ;
- le Comité scientifique sur les vaccins Covid-19 , présidé par Marie-Paule Kieny, a été créé le 4 juin 2020, pour exercer une triple mission de veille sur les vaccins, de conseil en matière d'essais cliniques et de conseil auprès de la « task force vaccins » placée auprès du ministère de la Santé 20 ( * ) . Il auditionne les laboratoires développant des candidats-vaccins pour pouvoir ensuite produire des recommandations.
Enfin, un Conseil d'orientation de la stratégie vaccinale , présidé par le Pr Alain Fischer, a été annoncé le 3 décembre 2020. Réunissant des experts scientifiques mais aussi des sciences humaines et sociales, des professionnels de santé, des élus et des représentants des patients, il a une mission large d'appui au Gouvernement dans la conception et la mise en oeuvre de la politique vaccinale et doit préparer la communication sur les questions scientifiques 21 ( * ) . Certains membres du comité scientifique sur les vaccins Covid-19 seront membres du Conseil d'orientation.
2. La mobilisation de nombreux acteurs dans la mise en oeuvre de la vaccination, nécessitant une coordination efficace
a. Plusieurs intervenants institutionnels dans la « logistique » de la « vaccination »
L'Agence nationale de santé publique appelée Santé Publique France (SPF) 22 ( * ) , qui assure des missions de suivi épidémiologique (notamment en fournissant les chiffres quotidiens de contamination et de mortalité par Covid), de veille et d'alerte sanitaire, d'éducation à la santé 23 ( * ) , a aussi une fonction opérationnelle de gestion de la réserve sanitaire et des stocks stratégiques, qui était dévolue à l'Établissement de préparation et de réponse aux urgences sanitaires (EPRUS) jusqu'à son intégration dans SPF en 2016. Dans le cadre de la vaccination, SPF a un rôle opérationnel stratégique dans la mesure où les stocks de vaccins seront considérés au moins dans un premier temps comme des stocks stratégiques et pourraient être placés sous la responsabilité de « l'établissement pharmaceutique » de SPF.
Les services centraux et déconcentrés du ministère des solidarités et de la santé mobilisés sont les suivants :
- la direction générale de la santé (DGS), qui pilote l'ensemble du dispositif de vaccination.
- la direction générale de l'offre de soins (DGOS), compétente à l'égard des hôpitaux ;
- la direction générale de la cohésion sociale (DGCS), compétente à l'égard des établissements d'hébergement de personnes âgées dépendantes (EHPAD) ;
- la direction de la sécurité sociale (DSS) devrait aussi être associée en lien avec la Caisse nationale d'assurance-maladie (CNAM).
Au niveau déconcentré, le pilotage opérationnel des opérations de vaccination devrait reposer sur les agences régionales de santé (ARS).
b. Quel rôle pour la « task force vaccins » ?
Une logistique efficace conditionne la réussite de la stratégie de vaccination et la confiance du public dans ses phases successives. Cette efficacité logistique dépend d'une bonne coordination des nombreux acteurs intervenant dans la mise en oeuvre effective des opérations de vaccination.
Pour coordonner les différents acteurs à l'échelle interministérielle, le Gouvernement a mis en place mi-novembre une « task force » interministérielle , placée auprès du Premier ministre et désormais auprès du ministre de la santé, dirigée par Louis-Charles Viossat. Elle est chargée de piloter la logistique de la campagne de vaccination (approvisionnement, stockage, distribution). Selon les informations fournies à l'OPECST, la « task force » ne serait pas une structure supplémentaire mais interviendrait en appui des administrations mobilisées pour la mise en oeuvre de la vaccination, et aurait essentiellement un rôle de coordination et de soutien en lien direct avec le cabinet du ministre de la santé.
3. Deux lectures possibles de la multiplication des conseils et comités
La multiplication des conseils et comités, alors qu'il existe dans le domaine de la santé, et plus particulièrement en matière de la vaccination, des organismes à qui la loi a confié des missions d'expertise et de conseil, peut paraître déroutante.
On pourrait voir ce choix des conseils et comités comme traduisant une défiance vis-à-vis des organismes et institutions intervenant habituellement en matière de vaccination et de crise sanitaire.
Cependant, la thèse de la défiance tient assez peu, dans la mesure où, par exemple, la HAS a été sollicitée pour présenter des recommandations en matière de stratégie de vaccination. Une approche plus positive consisterait à voir ces multiples instances créées spécialement pour la gestion de la vaccination contre le SARS-Cov-2, traduire la volonté des pouvoirs publics de s'entourer du plus large panel possible d'experts, avant toute prise de décision.
Recommandation Clarifier les rôles et fonctions de chacun des intervenants, disposer d'une vision précise du périmètre dévolu à chaque organisme, y compris dans la communication sur la stratégie de vaccination, afin d'éviter toute impression de cacophonie.
Recommandation Préserver le rôle du Parlement dans son rôle d'évaluation des politiques publiques et de contrôle de l'action du Gouvernement, qui prend les décisions et a la responsabilité finale de l'ensemble du dispositif de vaccination.
B. UNE STRATÉGIE DE VACCINATION VOLONTAIRE PROGRESSIVE PAR PHASES
L'objectif affiché est celui de la vaccination d'un maximum de personnes sur le territoire français - en tout cas de tous ceux qui souhaitent être vaccinés. Cet objectif passe par l'acquisition de 200 millions de doses (permettant de vacciner 100 millions de personnes en administrant 2 doses). La répartition des doses par fournisseur et le calendrier de livraison des doses n'est à ce stade pas connu avec précision, comme le souligne la recommandation de la HAS du 30 novembre dernier.
Outre les réticences possibles devant le manque de recul sur les effets des vaccins, une vaccination massive et rapide dès le début 2021 se heurterait de toute manière à un obstacle : des doses de vaccins en nombre insuffisant pour couvrir toute la population en quelques semaines. Ces contraintes conduisent à envisager un schéma de vaccination progressive, par phases successives, en fonction de critères objectifs recommandés par la HAS.
1. Une vaccination ciblée
Dans la perspective de l'arrivée sur le marché français des premiers vaccins contre la Covid-19 en 2021, la Haute Autorité de Santé (HAS) a publié une première note de cadrage le 23 juillet 2020 24 ( * ) , proposant les critères d'une future stratégie vaccinale : âge de la population, facteurs professionnels à risques, facteurs médicaux à risque, caractéristiques socio-éco-démographiques. Ces critères sont des facteurs essentiels à la mise en place d'une priorisation des publics ciblés selon le degré de disponibilité du vaccin et sa circulation. Ainsi, le comité vaccin Covid-19 définit ces populations dans un avis rendu le 9 juillet 2020 25 ( * ) .
Le 30 novembre 2020, la HAS a délivré un avis recommandant une vaccination en cinq phases 26 ( * ) . Chacune correspond à une étape dans l'approvisionnement national et européen en doses de vaccin. Elle postule l'efficacité de l'ensemble des vaccins développés sur toutes les populations visées .
LA STRATÉGIE DE VACCINATION PAR PHASES PROPOSÉE PAR LA HAS
|
Phase 1 : livraison des premières doses |
Stratégie reposant sur de potentiels clusters à haute criticité pouvant toucher des personnes à risque. |
|
Phase 2 : premières doses en quantités suffisantes |
Stratégie reposant sur l'âge et la présence de facteurs à risque (métier, comorbidités). |
|
Phase 3 : montée en charge de l'approvisionnement des vaccins |
Stratégie de réduction de la morbi-mortalité générale. |
|
Phase 4 : forte disponibilité des doses |
Stratégie de ciblage de personnes à risque potentiels (santé, milieu de vie), d'intérêt pour la nation. |
|
Phase 5 : personnes à risque déjà vaccinées, disponibilité complète du vaccin |
Ces différentes phases associent deux volets stratégiques : l'un reposant sur l'âge et les facteurs de santé à risque l'autre sur l'âge et des facteurs d'exposition.
LES DÉTERMINANTS DES PHASES DE VACCINATION
|
Stratégie reposant exclusivement sur l'âge et les facteurs de santé à risque |
Stratégie reposant sur des facteurs d'exposition à risque |
Nombre de personnes concernées |
|
|
Phase 1 |
Personnes âgées vivant en collectivité (EHPAD, USLD) : 750 000 personnes |
Personnel âgé (plus de 65ans) et/ou présentant des comorbidités travaillant dans des établissements accueillant des personnes âgées : environ 90 000 personnes |
840 000 personnes |
|
Phase 2 |
Personnes âgées (plus de 75ans) et/ou présentant des comorbidités en commençant par les plus âgées : 6,4M personnes *** Personnes âgées (65-74 ans) avec priorisation sur des personnes présentant des comorbidités : 7,3M de personnes dont 3M avec comorbidités |
Professionnels de santé (plus de 50 ans) et/ou présentant des comorbidités : 1,2M de personnes |
14 900 000 personnes |
|
Phase 3 |
Personnes d'âge à risque (50-65 ans) ou non vaccinées et présentant des comorbidités : 17M de personnes |
Opérateurs essentiels ayant des contacts étroits avec la population (enseignement, autres à définir) |
Au moins 17 000 000 personnes |
|
Phase 4 |
Personnes vulnérables et précaires vivant en collectivité (prisons, foyers, etc.) : environ 550 000 personnes |
Personnel prenant en charge les personnes vulnérables (non vaccinés précédemment) : environ 1,2M de personnes *** Personnes vivant ou travaillant dans des lieux clos favorisant l'infection (abattoirs par exemple) |
Au moins 1 700 000 personnes |
|
Phase 5 |
Personnes de 18 à 50 ans, non vaccinées antérieurement et susceptibles d'être infectées |
Environ 24 000 000 personnes |
|
Pour la HAS, auditionnée par l'Office, deux stratégies alternatives étaient possibles : cibler directement une immunité collective, notamment par une réduction de la transmission du virus en vaccinant les personnels en contact avec des personnes à risque (personnels soignants et d'EHPAD de tout âge) ; ou protéger les personnes les plus vulnérables par réduction de la morbi-mortalité liée au virus. Or la corrélation entre la morbi-mortalité et l'âge de la population ainsi que, dans une moindre mesure, la présence de facteurs de santé à risque, est très forte. Les sujets âgés, dont les âges limites sont à définir, constituent la population pour laquelle la balance bénéfice-risque des vaccins est la meilleure. Par ailleurs, les premiers candidats vaccins semblant conférer une bonne protection chez le sujet âgé et leur capacité à réduire la transmission du virus n'étant à ce jour pas démontrée, la HAS a basé ses recommandations sur une diminution de la morbi-mortalité liée à la Covid-19 en se focalisant sur l'âge puis sur la présence de facteurs de santé à risque .
Ainsi, la HAS propose une stratégie progressive en deux volets, reposant sur une décroissance de l'âge d'accès à la vaccination, plus rapide en présence de facteurs d'exposition à risque - personnel d'EHPAD et personnel soignant par exemple. Pour l'ensemble des personnalités scientifiques auditionnées, cette stratégie reposant sur l'âge fait sens car les premières doses vaccinales ne permettront de couvrir qu'une proportion limitée de la population. Vacciner les personnes les plus à risque de forme grave permettra de réduire l'impact de la crise sanitaire sur le système hospitalier, afin que celui-ci retrouve une activité normale.
Arnaud Fontanet, épidémiologiste, membre du Conseil scientifique mis en place par le gouvernement et auditionné par l'OPECST, s'interroge toutefois sur la place des médecins généralistes dans la stratégie vaccinale : dans la mesure où ces derniers auraient un rôle clef à jouer dans la stratégie, leur vaccination prioritaire peut être un levier d'adhésion de la population générale au vaccin. Ces inquiétudes sont partagées par les médecins libéraux 27 ( * ) qui considèrent l'importance de « donner l'exemple » pour renforcer l'adhésion vaccinale. Ils font aussi part d'une hésitation tant que les données scientifiques ne sont pas disponibles 28 ( * ) . Cette problématique devrait toutefois intervenir lorsque l'accès au vaccin sera plus large car ces derniers seront également vaccinés de manière séquentielle, comme la population générale, en fontion des facteurs de risque individuels - leur exposition accrue au SARS-CoV2 étant un risque supplémentaire. La même problématique se pose pour les personnels vaccinants de la phase 1, ceux-ci étant a priori en nombre limité par rapport aux nombre de premières personnes vaccinées (par exemple, en 2019, environ 110 000 personnels soignants en EHPAD pour un million et demi de vaccinés en phase 1). Une ouverture à la vaccination, reposant sur le volontariat de ces personnels, doit être considérée favorablement.
La question de l'administration d'un certain type de vaccin - correspondant à une certaine technologie - à une certaine population se pose également. Les premiers vaccins disponibles sur le marché le seront en quantité limitée : la priorité sera donc, au vu d'une analyse bénéfice/risque, de réduire la morbi-mortalité associée à une infection à la Covid-19 avec les vaccins dont on disposera en premier. Pour la HAS, l'arrivée successive de nouveaux vaccins permettra alors d'adapter l'administration des vaccins de manière ciblée, sous la responsabilité d'un médecin, selon la présence de contre-indications ou d'une forme d'efficacité préférentielle. Il sera donc du rôle de l'ANSM (ou de l'Agence européenne des médicaments), également auditionnée par l'Office, de proposer à chaque autorisation de mise sur le marché, une liste de recommandations et de contre-indications propres au vaccin en question. Le rôle du comité technique de vaccination (dépendant de la HAS) sera d'adapter la stratégie vaccinale en précisant, éventuellement, quelle sera la place de chaque vaccin commercialisé dans la stratégie vaccinale préétablie
Dans sa stratégie vaccinale, la HAS considère que « les données disponibles ne permettent pas d'orienter une vaccination des individus selon leur statut infectieux vis-à-vis du Sars-cov-2 ni selon l'immunité conférée par une infection antérieure au Sars-Cov-2 » 29 ( * ) . Cette considération et les implications qu'elle entraîne conduisent à des questionnements légitimes : Marc Bourquin, conseiller stratégique de la Fédération hospitalière de France (FHF), est critique sur ce point. En présence d'un nombre limité de doses, il questionne notamment la pertinence de vacciner en masse certains EHPAD où la moitié des résidents ont déjà été testé positifs à la Covid. Le professeur Alain Fischer, souligne cependant que les essais de phase 3 du candidat vaccin Pfizer/BioNTech ont inclus des personnes présentant des anticorps et que ces dernières ont répondu favorablement à la vaccination ; cela confirme l'intérêt de vacciner les personnes ayant déjà été infectées au Sars-CoV-2. Le comité vaccins présidé par Marie-Paule Kieny rappelle aussi les nombreuses incertitudes qui perdurent sur la durée conférée par une immunité naturelle : ne pas vacciner les personnes naturellement immunisées pourrait les exposer à un risque de développer une Covid plus tard. De plus, la réalisation d'une sérologie préalable à la vaccination complexifierait davantage l'organisation de la campagne vaccinale, d'autant que la qualité des tests sérologiques reste très hétérogène, a rappelé Olivier Schwartz, directeur de l'Institut Pasteur. La plupart des personnes auditionnées se sont accordées sur l'absence d'intérêt d'une sérologie préalable.
2. Une vaccination volontaire : convaincre pour réussir
L'obligation vaccinale est définie par le code de la santé publique 30 ( * ) . Avec l'extension des vaccins obligatoires pour les enfants de moins de 2 ans en 2018, seuls les professionnels s'opposant à la vaccination sont désormais directement sanctionnables au plan pénal ; toutefois une personne non vaccinée sera contrainte par le refus de l'accès des enfants à des structures collectives ou de l'adulte à certains emplois (par exemple personnel soignant, personnel de laboratoire, thanatopracteur) 31 ( * ) .
Le Gouvernement a choisi de ne pas rendre obligatoire la vaccination contre la Covid-19. De ce fait, il est impossible à qui que ce soit d'imposer la vaccination. Ainsi, un employeur ne pourrait pas imposer la vaccination ni établir des sanctions en son absence 32 ( * ) , car toute obligation vaccinale est exclusivement établie par le ministère chargé de la santé, après avis de la Haute autorité de santé 33 ( * ) .
La classification par l'Union européenne, le 3 juin 2020, du SARS-CoV-2 en risque infectieux de catégorie 3 34 ( * ) (1 étant le risque le plus faible, 4 le plus haut) conduit à l'application de l'article R. 4426-7 du code du travail, demandant à l'employeur « un suivi individuel renforcé dans les conditions prévues aux articles R. 4624-22 à R. 4624-28 du présent code ». Toutefois, l'article R. 4426-6 du même code 35 ( * ) prévoit qu'il ne pourrait s'agir que de recommandations sur proposition de la médecine du travail. Compte tenu de la jurisprudence, certains avocats considèrent que la possibilité d'une vaccination obligatoire devrait être clarifiée.
Un employeur peut néanmoins la recommander en s'appuyant sur la médecine du travail. Par ailleurs, s'il est donc impossible d'imposer des sanctions à un personnel non vacciné, il pourrait être envisageable qu'un employeur, estimant qu'une personne non vaccinée s'expose à un risque, affecte celle-ci à des tâches moins exposantes. L'exercice de cette possibilité ne peut être que mesuré, pour éviter d'entrer dans le cadre du harcèlement moral, défini par l'article L. 1152-1 du code du travail 36 ( * ) . En effet, « aucun salarié ne doit subir les agissements répétés de harcèlement moral qui ont pour objet ou pour effet une dégradation de ses conditions de travail susceptible de porter atteinte à ses droits et à sa dignité, d'altérer sa santé physique ou mentale ou de compromettre son avenir professionnel. »
La situation peut être bien différente dans d'autres pays. Aux États-Unis, où la vaccination contre la Covid-19 ne sera pas rendue obligatoire, le droit permet à un employeur d'adopter des sanctions disciplinaires - dont le renvoi - pour une personne non vaccinée 37 ( * ) .
La possession d'un certificat vaccinal pour accéder à certains services privés ou au voyage, sujet qui a fait récemment irruption dans le débat public 38 ( * ) , n'est pour le moment pas prévue en France. La proposition de la branche européenne de l'OMS de mettre en place un certificat numérique concerne seulement l'identification des personnes vaccinées ; il ne s'agit pas de créer un « passeport d'immunité », un tel document n'étant pas recommandé par l'OMS 39 ( * ) .
La vaccination étant volontaire, seule la conviction qu'elle est utile (pour soi ou pour autrui et en particulier ses proches) et non risquée (pour soi) conduira un maximum de personnes à prendre le chemin de la vaccination.
Recommandation Réaffirmer le caractère volontaire et gratuit de la vaccination.
Recommandation Réfléchir à un élargissement de la vaccination en phase 1 au personnel des EHPAD qui le souhaite, et pas seulement à ceux qui présentent des facteurs de risque.
Recommandation Ouvrir le plus rapidement possible l'accès à la vaccination aux personnes ciblées au-delà de la phase 1, présentant des facteurs de risque et facteurs d'exposition élevés.
Recommandation Affirmer l'importance d'une vaccination des professionnels de santé libéraux, dont les médecins généralistes directement au contact des Français.
C. DE LA SORTIE D'USINE DES DOSES DE VACCINS AU SUIVI DES PERSONNES VACCINÉES : LE DÉFI DE LA CHAÎNE DE VACCINATION
Au-delà des enjeux de sécurité et d'efficacité des vaccins, la confiance et l'adhésion au processus de vaccination passe par la maîtrise de la chaîne vaccinale et la bonne réalisation de chacune de ses étapes. Une série de défis sont à relever : installer une chaîne logistique efficace, réussir la 1 ère phase, enchaîner les phases suivantes en fonction du rythme de réception des doses par les laboratoires et enfin, établir des bilans d'étape des opérations de vaccination.
1. Installer une chaîne logistique efficace
Le premier vaccin qui sera disponible, celui de Pzifer BioNTech, présente des caractéristiques assez contraignantes, notamment en matière de chaîne du froid et de délai d'utilisation :
- nécessite de conservation des lots à très basse température (-80°C).
- obligation d'utiliser les doses décongelées assez rapidement : les flacons décongelés peuvent être conservés entre 2 et 8°C (dans un équipement frigorifique standard) pendant 5 jours, et doivent être utilisés immédiatement à température ambiante jusqu'à 25°C. Chaque lot comprendrait 200 flacons.
- limitation à 12 heures de la durée totale de transport des doses décongelées.
- nécessité d'effectuer une dilution de la substance active en mélangeant à du sérum physiologique (chlorure de sodium) : chaque flacon permet d'effectuer 5 injections. Les solutions diluées doivent être utilisées sous 6 heures.
- réalisation d'une seconde injection du même vaccin 21 jours après la 1 ère injection.
Il est donc indispensable de mettre en place une chaîne logistique efficace pour garantir la qualité de l'acte de vaccination, qui passe aussi par la bonne organisation des opérations de vaccination.
Les enjeux repérés à ce stade sont les suivants :
a- L'organisation d'un circuit de distribution des stocks de vaccins : réception et stockage des lots reçus des laboratoires, répartition sur le territoire, en n'oubliant pas les territoires ultramarins pour lesquels des circuits spécifiques devront être mis en place, car une livraison rapide par les plateformes logistiques hexagonales disposant de super-congélateurs y est impossible, livraison des vaccins et des autres matériels nécessaires à l'acte de vaccination (aiguilles, seringues, sérums physiologique, gants, masques etc.) aux équipes chargées de vacciner, éventuellement récupération des lots non utilisés et gestion des déchets issus des opérations de vaccination 40 ( * ) .
Pour la conservation à très basse température des lots de vaccins, des commandes d'une centaine de ces super-congélateurs ont été passées sous l'égide de SPF et ces équipements sont en cours d'installation dans les lieux de stockage de masse, dans le respect d'un cahier des charges technique et de sécurité. Il conviendra que le respect de la chaîne du froid soit sérieusement contrôlé et ce à chaque étape de la distribution des lots.
Lors de sa conférence de presse du 3 décembre, le ministre Olivier Véran a indiqué que le plan de transport serait testé à blanc d'ici la fin du mois de décembre. Selon les informations fournies par le directeur adjoint de cabinet du ministre, Clément Lacoin lors de son audition du 14 décembre 2020, deux circuits de distribution ont été élaborés pour la 1 ère phase, qui se déroulera avec le seul vaccin disponible Pfizer BioNTech :
- environ les 3/4 des doses seront réceptionnées sur 6 plateformes gérées par les dépositaires pharmaceutiques, qui livreront ensuite les pharmacies à usage intérieur (PUI) des EHPAD lorsqu'elles existent ou les officines pharmaceutiques de référence qui assurent l'approvisionnement habituel des EHPAD, lorsque ceux-ci ne disposent pas d'une PUI. Le schéma retenu vise à s'appuyer sur les circuits habituels d'approvisionnement des EHPAD, qui sont ceux également utilisés pour distribuer le vaccin contre la grippe, afin de limiter les difficultés dans la distribution du vaccin aux établissements.
- 1/4 des doses seront réceptionnées dans les pharmacies d'hôpitaux de référence (un par département) disposant d'un super-congélateur. Ces plateformes alimenteront les EHPAD et USLD qui y sont rattachés, mais également des EHPAD géographiquement proches qui demanderaient pour des raisons pratiques à être livrés par ce canal.
b- La mise en place d'un dispositif humain : si des équipes mobiles dédiées de vaccination pourraient être envisagées pour procéder aux premières vaccinations collectives, une vaccination de masse n'est envisageable qu'en mobilisant largement les professionnels de santé qui le demandent : médecins libéraux, infirmières, peut-être pharmaciens (qui sont désormais habilités à effectuer les vaccinations contre la grippe). Une formation des personnels devant intervenir pourrait être nécessaire, même si une vaccination intramusculaire est un acte simple.
Le précédent de la vaccination contre la grippe H1N1 en 2009-2010, qui avait reposé exclusivement sur des centres de vaccination, en écartant les professionnels de ville, est jugé négativement. L'absence d'association des professionnels de ville a probablement contribué à la faible couverture vaccinale (environ 9 % à l'issue de la campagne de vaccination).
c- La mise en place d'une logistique d'information : sur les lieux possibles de vaccination, en lien le cas échéant avec les communes pour identifier et mettre à disposition des espaces dédiés, voire l'édition de bons de vaccination indiquant à chacun son ordre de priorité. La logistique d'information est aussi importante pour tracer les opérations de vaccination en identifiant les lots utilisés, les personnes concernées, permettant de déclencher les éventuels rappels de vaccination.
Il existe déjà des systèmes d'information pour effectuer un suivi vaccinal, notamment le carnet de vaccination électronique, peu utilisé (plateforme : mesvaccins.net).
En tout état de cause, la réalisation de la vaccination devra donner lieu à l'émission d'un certificat de vaccination (selon des modalités à définir), qui risque d'être exigé à l'avenir, par exemple pour pouvoir voyager.
2. Réussir la première phase
La 1 ère vague de vaccination est contrainte par le nombre réduit de doses disponibles. Lors de son audition par les rapporteurs de l'OPECST le 9 novembre dernier, Elisabeth Bouvet, présidente de la commission technique des vaccinations de la HAS, estimait que l'on ne devrait disposer dans un premier temps que de 3 à 4 millions de doses, ne permettant de vacciner que 1,5 à 2 millions de personnes (à raison de 2 doses par personne vaccinée).
La recommandation de la HAS consistant à vacciner en priorité les résidents des EHPAD et services de long séjour hospitalier ainsi que les personnels de santé à risque (critère d'âge et de comorbidité), soit un peu moins d'un million de personnes, la 1 ère phase sera assez centralisée (moins de 10 000 établissements).
La mise en oeuvre de la vaccination, qui ne pourrait se faire qu'avec le seul produit disponible, le vaccin Pfizer BioNTech, devrait être relativement simple, sur la base d'un calendrier établi par les ARS après concertation avec les établissements concernés.
Les responsables des maisons de retraite publiques comme privées ont néanmoins attiré l'attention des rapporteurs de l'OPECST lors de leur audition du 10 décembre sur quelques points délicats :
- L'information et le consentement des résidents à la vaccination : la vaccination n'étant pas obligatoire, il conviendra qu'une consultation médicale soit préalablement effectuée pour examiner la pertinence de l'indication pour chaque résident. Or, 30 % des EHPAD n'ont pas de médecin coordonnateur et dans beaucoup d'autres, il ne passe dans l'établissement qu'une fois par semaine, ce qui risque de compliquer l'organisation de cette consultation pré-vaccinale. Ensuite, le consentement à la vaccination devra être exprimé par le résident, ou, en cas d'impossibilité, par son tuteur ou sa personne de confiance. Les responsables des maisons de retraite auditionnés le 10 décembre réclament une procédure renforcée de consentement explicite écrit et pas seulement une trace dans le dossier médical (pour la vaccination contre la grippe dans les maisons de retraite, il n'existe pas de consentement). Lors de son audition du 14 décembre 2020, le directeur adjoint de cabinet du ministre de la santé, Clément Lacoin, indiquait qu'un avis était demandé au Comité consultatif national d'éthique (CCNE) sur les modalités du consentement. En tout état de cause, un tel consentement ne peut être exprimé que sur la base d'une information suffisante, ce qui implique de ne le recueillir qu'après l'autorisation de mise sur le marché et un avis attendu fin décembre de la HAS. Afin d'anticiper les difficultés liées au recueil du consentement, les EHPAD sont incités à organiser au plus tôt l'information des familles.
- La question des moyens à mobiliser pour les opérations de vaccination se pose aussi : la projection sur les établissements d'équipes mobiles de vaccination éviterait de surcharger les équipes sur place, déjà occupées par les activités habituelles et garantirait une qualité élevée des opérations de vaccination elles-mêmes, mais l'association des équipes « locales » paraît indispensable pour renforcer la confiance dans la vaccination.
Lors de son audition, Clément Lacoin a également indiqué qu'il était préférable que les consultations pré-vaccinales soient effectuées dans les EHPAD par les médecins traitants des résidents, qui connaissent bien leurs patients. Ces consultations sont plus faciles à organiser lorsque de nombreux résidents ont le même médecin traitant. A défaut de consultation par le médecin traitant, un autre médecin pourrait être mobilisé. L'acte de vaccination en lui-même devrait être effectué en présence d'un médecin, par ce dernier ou par du personnel infirmier.
En tout état de cause, il convient d'être prudent dans la mise en oeuvre de cette première phase, en ne cherchant pas à aller trop vite : la 1 ère phase pourrait ainsi être étalée entre janvier et mars. Au demeurant, un délai d'au moins 10 à 15 jours risque d'être nécessaire entre le dernier avis de la HAS après l'autorisation donnée au vaccin et les premiers actes de vaccination, afin de pouvoir réaliser dans chaque EHPAD toutes les consultations pré-vaccinales.
3. Élargir progressivement la vaccination à partir de la 2 ème phase en s'appuyant sur l'ensemble des professionnels de santé
L'entrée dans la 2 ème phase de la campagne de vaccination marquera le début de la massification des opérations, en l'ouvrant progressivement à la population générale.
L'organisation de la 2 ème phase est encore imprécise mais plusieurs enjeux ont été bien identifiés :
- comment gérer la « file d'attente » et faire en sorte que les vaccins disponibles iront bien aux publics prioritaires ?
- comment réaliser les vaccinations ? S'appuyer sur le réseau des professionnels libéraux constitue un impératif à la fois logistique et pour convaincre la population de l'utilité de la vaccination, en jouant sur le lien privilégié avec ces acteurs de santé de proximité.
- vers quel vaccin orienter chaque individu, dès lors qu'il en existera plusieurs sur le marché ? À partir de la 2 ème phase, il faudra en effet combiner massification et personnalisation de la vaccination.
a. Prendre appui sur le réseau des professionnels de santé de ville
Plusieurs raisons plaident en faveur d'une vaccination s'appuyant sur les professionnels de ville : médecins généralistes (environ 100 000), infirmiers libéraux (125 000) voire pharmaciens (21 000 officines). Ces professionnels sont déjà interrogés sur la vaccination par les patients. Ils pratiquent déjà des actes courants de vaccination (vaccinations pédiatriques, vaccination contre la grippe saisonnière). Ils ont un contact privilégié avec les publics vulnérables, premiers concernés par la vaccination contre le SARS-Cov-2, car ils les voient régulièrement en consultation et pourraient réaliser facilement la vaccination à l'occasion des consultations habituelles en cabinet, dès lors qu'ils disposeraient de stocks de vaccins faciles à conserver (ce qui n'est pas le cas pour le Pfizer BioNTech).
Permettre aux médecins libéraux de prescrire et réaliser (ou faire réaliser par des cabinets infirmiers de ville) des vaccinations permet aussi d'orienter les patients vers les vaccins présentant le moins de contre-indication possible, compte tenu du profil de chacun.
Un tel dispositif pourrait renforcer l'adhésion à la vaccination, qui se nouerait dans la relation de confiance entre les médecins et leurs patients.
Lors de son audition par l'OPECST le 10 décembre, le directeur général de la santé Jérôme Salomon indiquait privilégier la vaccination en cabinet médical, parfaitement compatible avec une vaccination massive : on est parvenu à vacciner en 2020 contre la grippe 15 millions de personnes en 6 semaines.
Pour autant, plusieurs conditions semblent nécessaires pour réussir l'association des professionnels de santé de ville.
1 ère condition : la fourniture d'un bon niveau d'information médicale sur les vaccins disponibles et leurs effets à ces professionnels. Cette exigence a été rappelée par plusieurs représentants de la médecine libérale auditionnés le 10 décembre 2020 par vos rapporteurs. Lors de son audition, Jérôme Salomon précisait que plusieurs outils pourraient être mis en place : une fiche d'information normalisée validée par des experts et une liste de contre-indications. La question de la forme du consentement est cependant là aussi en débat.
2 ème condition : la clarification de la question de la responsabilité suite à des accidents de vaccination. Il s'agit là d'une véritable inquiétude des professionnels. Il existe certes un régime d'indemnisation, géré par l'Office National d'Indemnisation des Accidents Médicaux (ONIAM), mais des clarifications sont attendues sur ce point par les professionnels, d'autant plus que la nouveauté des vaccins suscite des interrogations (voir encadré).
En matière d'indemnisation des victimes de mesures vaccinales, l'ONIAM intervient dans 3 situations :
- lorsque la vaccination est obligatoire (par exemple dans le cadre d'un exercice professionnel) dans le cadre de l'article L. 3111-9 du code de la santé publique. Le financement des mesures d'indemnisation est assuré par des crédits d'État.
- lorsqu'un arrêté ministériel prescrit une campagne de vaccination en réponse à une menace sanitaire grave (procédure prévue par l'article L.3131-1 du code de la santé publique), l'article L.3131-4 du même code de la santé publique prévoit que l'ONIAM prend en charge les indemnisations. Le financement est aussi assuré par des crédits d'État. Un arrêté avait été pris en 2009-2010 durant la campagne de vaccination contre le virus H1N1 (environ 200 demandes d'indemnisation et environ 60 indemnisations accordées).
- lorsque la vaccination n'est pas obligatoire et que l'on n'est pas dans le cadre de mesures sanitaires d'urgence, l'ONIAM intervient pour l'indemnisation mais après la procédure classique des Commissions de Conciliation et d'Indemnisation des Accidents Médicaux des Affections Iatrogènes et des Infections Nosocomiales (CCI), sur des crédits de l'assurance-maladie.
b. La mise en place éventuelle de centres de vaccination
Le recours aux professionnels de ville n'exclut toutefois pas la mise en place à titre subsidiaire de centres de vaccination, par exemple pour les populations non suivies par des généralistes ou encore afin de regrouper des professionnels de santé dans un lieu centralisé dédié.
Lors de son audition, le directeur général de la santé indiquait ne pas envisager la mise en place de « vaccinodromes » sur le modèle de ceux mis en place pour la vaccination contre la grippe A en 2009-2010 (1 168 centres alors ouverts en retenant le principe d'un centre pour 100 000 habitants et au moins trois centres par département 41 ( * ) ).
Lors de son audition au nom de l'Association des maires de France, Frédéric Chéreau indiquait que les mairies étaient prêtes à aider les professionnels de santé à s'organiser en mettant à disposition des lieux, comme cela a été fait pour les centres de dépistage Covid, mais demandait aussi à ce que des moyens spécifiques soient déployés pour couvrir les déserts médicaux.
4. Disposer d'une vaccinosurveillance performante
Où qu'elle soit réalisée, la vaccination devra faire l'objet d'une traçabilité forte, y compris des opérations de préparation finale des vaccins juste avant l'injection. Cette traçabilité n'est pas requise pour des raisons administratives liées au remboursement par l'assurance-maladie, dans la mesure où les vaccins sont mis à disposition gratuitement. Elle s'impose plutôt afin d'effectuer une remontée très précise et rapide d'éventuels effets indésirables et pour mesurer l'efficacité de la vaccination. Une bonne traçabilité est l'une des conditions de la confiance dans la vaccination.
L'ANSM a annoncé qu'elle exercerait une vaccinovigilance renforcée en effectuant un suivi hebdomadaire de la tolérance aux vaccins.
La vaccinovigilance passe par un recueil de données sur les vaccins réalisés très précis dans un système d'information qui reste à définir. Il s'agira d'une étape « administrative » indispensable qui devra être réalisée par ceux qui pratiqueront la vaccination.
Lors de son audition, Clément Lacoin a indiqué que trois systèmes d'information seraient opérationnels dès le début de janvier 2021 pour assurer le suivi fin de la vaccination dans tous ses aspects, notamment les aspects logistiques ou encore la remontée d'effets indésirables.
Recommandation Achever la définition de la chaîne logistique à mettre en place pour stocker et distribuer les vaccins, en respectant les conditions de conservation des lots, en anticipant la question de l'administration de la deuxième dose et en organisant l'élimination des déchets.
Recommandation Ne pas se précipiter pour la réalisation de la première phase, et définir un protocole pour le recueil du consentement dans les EHPAD qui pourrait prendre appui sur une fiche d'aide à la décision et au consentement.
Recommandation S'appuyer de manière privilégiée sur les professionnels de santé de ville pour réaliser les vaccinations à partir de la 2 ème phase, en leur fournissant au préalable une information complète sur les vaccins et le processus de vaccination, afin qu'ils puissent être les référents de leurs patients en matière d'information sur la vaccination.
Recommandation Sécuriser juridiquement l'intervention des professionnels de santé vaccinateurs en prenant un arrêté ministériel prévoyant l'intervention de l'ONIAM pour l'indemnisation des accidents de vaccination.
Recommandation Construire un système d'information simple et complet afin de tracer l'ensemble des vaccinations opérées et remonter en temps réel les effets indésirables.
D. DES STRATÉGIES NATIONALES DE VACCINATION DÉCLINÉES DANS UN CADRE EUROPÉEN
Le Centre européen de prévention et de contrôle des maladies a publié un panorama des stratégies vaccinales définies dans les États membres de l'Union européenne et au Royaume-Uni, premier pays à déployer un vaccin 42 ( * ) . Le document n'a cependant pas été mis à jour après le 2 décembre 2020.
L'Allemagne et l'Espagne fournissent deux exemples de stratégie nationale dans des pays de taille comparable à la France.
1. Le cas allemand
a. La définition par le Parlement du cadre de la stratégie vaccinale
Le Bundestag a défini le cadre de la stratégie vaccinale dans la loi du 18 novembre 2020, dite « loi de protection de la population en situation épidémique d'ampleur nationale » 43 ( * ) . Le texte inclut à la fois des dispositions de fond et des dispositions qui encadrent le processus décisionnel.
i. Esquisse législative d'un ordre de priorités entre personnes à vacciner
Sur le fond, le Parlement habilite le gouvernement fédéral à ouvrir aux assurés sociaux le droit à une vaccination, « en particulier en raison de leur âge et de leur état de santé, ou lorsqu'ils traitent ou soignent de tels patients, ou lorsqu'ils occupent des positions-clés dans l'accomplissement de fonctions régaliennes . » (art. 4) Il autorise également la collecte de données sur les personnes vaccinées, sous forme pseudonymisée : sexe, pseudo, âge, code postal, arrondissement d'exercice et spécialité du médecin traitant, date de l'injection, numéro de vaccination, ordonnance d'injection, dates de la série de vaccination. (art. 1)
Seul un groupe politique paraît s'être saisi du sujet de la stratégie vaccinale en tant que telle. Le groupe Die Linke a déposé le 17 novembre 2020 une motion où il appelle à la prudence, en particulier pour les vaccins à ARNm 44 ( * ) .
ii. Un processus décisionnel prévoyant une large consultation institutionnelle et territoriale
En matière de processus décisionnel, le Parlement a prévu la consultation obligatoire de la commission permanente des vaccinations ( Ständige Impfkommission , ou Stiko), placée auprès de l'Institut Robert Koch, homologue allemand de l'Institut Pasteur. Le lundi 7 décembre, cette commission a publié et transmis aux Länder un projet de recommandations. À l'issue du délai de réponse, elle a publié ses recommandations définitives le jeudi 10 décembre. Le gouvernement fédéral devrait reprendre le contenu de ses recommandations dans un décret ( Rechtsverordnung ).
b. Le cadre défini par le gouvernement fédéral sur la base des recommandations de la Stiko
i. Des quantités inférieures aux besoins prioritaires définis par la Stiko
Les recommandations de la Stiko établissent un ordre de priorité dans l'administration du vaccin : résidents des maisons de retraite ; personnes de 80 ans et plus ; personnel particulièrement à un risque de contamination dans les établissements de santé ; personnel des établissements de santé en contact rapproché avec les groupes vulnérables ; personnel de soins dans les centres de soins stationnaires et ambulatoires aux personnes âgées. Les collaborateurs des organes de sécurité étatiques ne feront donc pas partie de la première vague, non plus que l'ensemble des médecins.
Selon les indications de la Stiko, près de 9 millions de personnes seraient concernées. Dans le même temps, le ministre de la Santé Jens Spahn estime que 3 millions de doses devraient être disponibles en janvier, soit une quantité suffisante pour vacciner 1,5 millions de citoyens, à raison de 2 injections par personne.
Les recommandations reposent sur l'hypothèse d'une autorisation, par l'Agence européenne du médicament, du vaccin BNT162b2 de l'entreprise BioNTech.
ii. Modes d'administration du vaccin
La Stiko recommande une administration exclusivement intramusculaire du vaccin. Les deux doses vaccinales doivent être injectées à 21 jours d'intervalle. La commission souligne que l'achèvement des séries vaccinales a priorité sur la vaccination d'autres personnes. Les centres de vaccination doivent faire des réserves en conséquence. La série vaccinale doit en outre être achevée en utilisant un produit identique.
Dans un premier temps, il ne faut pas vacciner les personnes qui ont déjà eu la maladie. La commission laisse ouverte la question de savoir si elles devront l'être par la suite.
Selon la Stiko, il n'est pas nécessaire d'établir un diagnostic viral avant la vaccination. Il convient cependant de renoncer à la deuxième injection si la personne vaccinée est contaminée après la première injection. Les autres vaccinations, notamment contre la grippe, doivent se dérouler en respectant un intervalle de 14 jours.
Après injection, la Stiko recommande au minimum 5 minutes de temps d'observation. Ce temps d'observation est porté à 15 à 30 minutes lorsque les personnes vaccinées sont des personnes à risque, en particulier celles qui reçoivent un traitement anticoagulant, qui sont atteintes de maladies vasculaires ou qui ont déclarées, lors de l'anamnèse, être sujettes à des chocs vaccinaux anaphylactiques.
2. Le cas espagnol
a. La gouvernance de la stratégie vaccinale
Dotée d'un système de santé national ( Sistema Nacional de Salud ou SNS) décentralisé, l'Espagne dispose d'une instance de coordination entre l'État central et les communautés autonomes en matière de santé, créée par la loi générale sur la santé de 1986 ( Ley 14/1986 General de Sanidad ) : le Conseil interterritorial du système national de santé ( Consejo Interterritorial del Servicio Nacional de Salud ou CISNS), chargé de fixer les règles de base en matière de politique de santé, d'acquisitions de produits sanitaires et pharmaceutiques, ainsi que de statut des personnels de santé.
À ce jour, le CISNS, dont la composition et les compétences ont été modifiées par la loi de 2003 sur la cohésion et la qualité du système de santé ( Ley 16/2003 de cohesión y calidad del Sistema Nacional de Salud ), est constitué des conseillers de santé des communautés autonomes et des villes, ainsi que du ministre de la santé espagnol. Il fonctionne suivant plusieurs modalités : en sessions plénières, ou au travers de comités délégués, commissions techniques et groupes de travail.
Le 9 septembre 2020, le CISNS a approuvé en session plénière une déclaration sur l'action coordonnée dans le domaine de la santé publique prévoyant :
- la mise en oeuvre d'une stratégie de vaccination unique sur tout le territoire, élaborée en prenant compte à la fois l'avis d'experts en bioéthique et des sociétés savantes, puis approuvée en session plénière ;
- la mise à disposition par les communautés autonomes des équipements, des ressources et matériels nécessaires à l'administration des vaccins fournis par le ministère de la Santé ;
- la création, par le ministère de la santé, d'un registre national des vaccinations Covid-19, en collaboration avec les communautés autonomes et les villes.
À cette fin, un groupe de travail technique dédié à la vaccination contre la Covid-19 (GTV) a été créé, coordonné par le ministère de la Santé et dépendant du comité de la vaccination du CISNS. Il est constitué de représentants de ces deux derniers organes, des sociétés savantes, de l'Agence espagnole des médicaments et des produits de santé (AEMPS), du Centre de coordination des alertes et des urgences sanitaires (CCAES) ainsi que d'experts en bioéthique, sociologie et méthodologie.
Le Comité des vaccins du CISNS et le GTV sont chargés de mettre à jour la stratégie à mesure que progressera la mise en oeuvre de celle-ci, les caractéristiques et les connaissances sur la disponibilité des vaccins. De plus, un groupe consultatif interministériel est mis en place pour faciliter la planification et la mise en oeuvre de la stratégie de vaccination à destination des groupes prioritaires.
Contrairement à l'Allemagne, en Espagne le Parlement n'a pas été directement impliqué dans la préparation de la stratégie vaccinale. Les grandes lignes de celle-ci ont été présentées par le ministre de la Santé au Congrès des députés, la chambre basse des Cortes Generales, à l'occasion de l'examen du budget de la santé 2021, le 2 décembre 2020, puis à la commission pour la santé et de la consommation.
b. Les grandes lignes de la stratégie vaccinale
Le ministère de la Santé espagnol a publié le 23 novembre 2020 les grandes lignes de la stratégie vaccinale contre la Covid-19 en Espagne 45 ( * ) .
L'objectif global de cette stratégie est de « réduire la morbidité et la mortalité causées par cette maladie, en protégeant les groupes les plus vulnérables par la vaccination dans un contexte de disponibilité progressive des vaccins. »
i. Approvisionnement
L'Espagne a choisi d'être partie prenante à la stratégie de l'Union européenne en matière de vaccins. L'AEMPS représente le pays dans les instances européennes, le ministère de la Santé se chargeant de l'acquisition des doses. Une fois la disponibilité effective de celles-ci acquise, l'ordre de priorité définitif par groupes de population et l'attribution de doses à chacune des communautés autonomes seront décidés en séance plénière du CISNS.
L'Espagne devrait recevoir 140 millions de doses de vaccin permettant d'immuniser 80 millions de personnes, alors que la population du pays n'est que de 47 millions d'habitants. Les doses excédentaires permettront de faire face si un ou plusieurs vaccins venaient à ne pas être autorisés ou seront envoyées dans des pays tiers, en vertu du principe de solidarité.
Le ministre de la santé a précisé que la vaccination sera effectuée sur la base du volontariat et de façon identique dans tout le pays.
ii. Cadencement
Pour établir la hiérarchisation par catégories de personnes à vacciner en priorité, quatre critères ont été pris en compte : le risque de morbidité et de mortalité sévères, le risque d'exposition, le risque d'impact socio-économique et le risque de transmission. Cette analyse a été faite sur la base des informations disponibles sur les caractéristiques des premiers vaccins.
Dans une première phase allant de janvier à mars 2021, quatre catégories de personnes seront vaccinées : les résidents et le personnel sanitaire et socio-sanitaire des résidences pour personnes âgées et handicapées, puis les personnels de santé en première ligne, les autres personnels de santé et socio-sanitaires, et les personnes dépendantes non institutionnalisés. Ces groupes prioritaires comprennent environ 2,5 millions de personnes. La deuxième phase de vaccination vise à couvrir d'autres groupes prioritaires, non encore précisés, de mars à juin 2021. La troisième phase concerne a priori le reste de la population espagnole qui devrait être vaccinée en l'espace d'un an.
iii. Distribution
Les vaccins seront distribués gratuitement dans environ 13 000 centres de santé existants, répartis sur le territoire, équipés pour vacciner le public. L'Espagne développe simultanément la logistique nécessaire à la distribution des vaccins les plus exigeants, comme celui de Pfizer.
iv. Communication
L'Espagne lancera deux campagnes de communication sur les vaccins à l'attention, d'une part, des professionnels de santé et, d'autre part, du grand public.
La stratégie de communication respectera les principes suivants : véracité (informations sur les avantages et risques de la vaccination basées sur les preuves scientifiques disponibles), transparence (des informations véridiques doivent être fournies à tout moment, de manière claire et accessible mentionnant également des incertitudes), participation (les doutes de la population et des personnels de santé seront entendus pour orienter la stratégie de communication), équité (les messages seront adaptés au public pour garantir l'accessibilité, une attention particulière sera accordée aux personnes handicapées) et évaluation (l'information sera réévaluée périodiquement).
III. AXE 3 - LA DIMENSION ÉCONOMIQUE, INDUSTRIELLE ET FINANCIÈRE
A. DES VACCINS AU MEILLEUR PRIX ET DANS LES MEILLEURS DÉLAIS : UNE STRATÉGIE EUROPÉENNE SUR LA BONNE VOIE MAIS ENCORE PERFECTIBLE
1. L'Union européenne : une stratégie prudente reposant essentiellement sur les volumes
a. L'Alliance inclusive et le « choix du collectif » : un progrès majeur pour l'Europe
Contrairement à son volet logistique et à son volet relatif à la confiance des citoyens, le volet économique et financier de la stratégie vaccinale française se joue principalement au niveau européen.
Dès le début, en effet, la France a fait « le choix du collectif » dans sa stratégie d'achats de vaccins auprès des producteurs, proposant dès le mois de septembre à ses partenaires européens de négocier ensemble avec les laboratoires pharmaceutiques afin d'obtenir de meilleures conditions. Les négociations ont été menées par la task force de l'Alliance inclusive regroupant plusieurs États-membres, dont la France 46 ( * ) .
Les contrats négociés par l'Alliance prévoient pour l'ensemble des États-membres :
• un prix identique ;
• une livraison au même moment ;
• des volumes au prorata de la population, soit 15 % pour la France.
À ce jour, six contrats d'achats de vaccins ont été signés au nom de l'ensemble des États-membres par la Commission européenne avec les laboratoires pharmaceutiques (Pfizer-BioNTech, CureVac, Sanofi-GSK, AstraZeneca, Johnson & Johnson et Moderna), pour un montant total d'environ 12 Md€ correspondant à la fourniture de près de 1,3 milliard de doses.
Les résultats obtenus par les pays européens doivent s'apprécier, notamment, au regard de ceux obtenus par les États-Unis, dont les volumes et les besoins sont similaires, mais aussi en comparaison de ceux obtenus par les pays qui ont opté pour une stratégie individuelle, à commencer par le Royaume-Uni.
Toutefois, avant même de procéder à l'analyse détaillée des différentes stratégies retenues, il faut souligner que la démarche collective européenne constitue en tant que telle une avancée majeure , non seulement parce qu'il s'agit de la première fois qu'elle est mise en oeuvre, mais aussi parce que les premiers mois de l'épidémie ont été marqués par un grave manque de coordination entre pays européens (s'agissant de la fermeture des frontières, de l'achat de masques, etc.), au détriment parfois de l'intérêt commun, et que les seules initiatives portées au niveau européen n'ont guère brillé par leur réussite, à l'instar de l'étude clinique Discovery sur l'efficacité comparée de quatre pistes thérapeutiques, qui n'a pas permis d'identifier de traitement efficace contre la maladie et a échoué à rassembler des effectifs significatifs à l'échelle européenne. Ainsi, même si les choses demeurent perfectibles, on ne peut que saluer les progrès qui ont été accomplis en l'espace de seulement quelque mois, et formuler le voeu que la crise actuelle permette d'aller encore plus loin.
Ces progrès ressortent clairement de la comparaison avec les contrats d'achat de vaccins contre la grippe H1N1 en 2009, négociés au niveau national par l'EPRUS, dans des conditions très dérogatoires au code des marchés publics, et où l'État s'est trouvé, compte tenu de l'urgence et de l'impossibilité de faire pleinement jouer la concurrence, en position particulièrement défavorable (cf. infra ).
Enfin, la centralisation des négociations au niveau européen pourrait aussi constituer un progrès important en termes de prévention des conflits d'intérêts ( cf. axe 4), en écartant le risque d'éventuelles collusions qui pourraient avoir lieu au niveau de chaque État-membre.
b. La mutualisation des commandes : un facteur important mais pas suffisant
Si les contrats conclus avec les laboratoires pharmaceutiques ne sont pas publics, il est toutefois possible de reconstituer approximativement le prix payé par chaque pays pour ses achats de vaccins, notamment à partir des volumes annoncés au titre de chaque contrat et des prix communiqués individuellement par certains laboratoires, ou à défaut à partir des montants payés par les États-Unis (qui sont publics).
Il apparaît ainsi que les pays européens, dont la France, ont payé aux alentours de 9 euros par dose, contre 7,50 euros par dose pour les États-Unis, soit une différence de près de 20 % . Le Royaume-Uni a probablement payé un prix supérieur, quoique dans des proportions difficiles à estimer (cf. infra ).
LA NÉGOCIATION AVEC LES LABORATOIRES PHARMACEUTIQUES : RÉSULTATS COMPARÉS DES STRATÉGIES DE L'UNION EUROPÉENNE, DU ROYAUME-UNI ET DES ÉTATS-UNIS
Estimations OPECST réalisées à partir des informations officielles publiées par la Commission européenne, le ministère de la Santé américain, les gouvernements français et britannique, les laboratoires pharmaceutiques et les agences de presse.
|
Précommandes de vaccins par l'Union européenne |
dont France (15 %) |
Sources : annonces officielles (en vert) à jour au 13 décembre 2020 pour les volumes, et estimations OPECST pour les prix, d'après les prix payés par les États-Unis et les annonces des laboratoires.
Cet écart de 20 % du prix unitaire entre l'Europe et les États-Unis interpelle à deux égards :
• d'une part, il n'est pas justifié par une différence de volumes, les pays européens ayant commandé davantage de doses (1,3 milliard) que les États-Unis (1,1 milliard), ces proportions se retrouvant pour les commandes optionnelles ;
• d'autre part, ce surcoût n'a pas pour autant permis aux pays européens d'être approvisionnés plus vite, alors que le Royaume-Uni et les États-Unis ont déjà démarré leur campagne de vaccination (respectivement les 8 et 14 décembre). Certes, le démarrage effectif de la vaccination dépend avant tout de l'autorisation de mise sur le marché délivrée par l'EMA, qui est attendue le 29 décembre pour le vaccin de Pfizer-BioNTech. Toutefois, l'approvisionnement en amont constitue un facteur-clé de réussite de la campagne vaccinale. En outre, si la politique d'achat est en principe dépendante de la décision des autorités sanitaires, le déroulement des négociations suggère que les liens sont en réalité plus complexes (cf. infra ).
Il apparaît donc que la mutualisation des commandes , qui a sans nul doute permis d'obtenir des tarifs inférieurs à ceux d'une juxtaposition de contrats individuels, n'est pas le seul facteur permettant d'obtenir des vaccins au meilleur prix et dans les meilleurs délais .
Les autres déterminants correspondent, en fait, aux deux piliers de la stratégie de l'Union pour les vaccins présentée par la Commission européenne le 17 juin 2020
• d'une part, la signature de contrats d'achat anticipés avec les producteurs afin de garantir la production d'une quantité suffisante de vaccins dans l'UE ;
• d'autre part, le recours aux procédures accélérées d'autorisation des vaccins par l'Agence européenne du médicament (EMA), dans le respect des critères de qualité, d'innocuité et d'efficacité applicables aux vaccins.
c. L'investissement initial, faiblesse principale des pays européens
Les pays européens ont privilégié un modèle prudent de précommandes, qui permet aux États-membres d'acheter un certain nombre de doses dans un délai donné, le paiement final n'intervenant que si certaines conditions sont remplies (en l'espèce, l'obtention de l'AMM, garantissant la qualité, l'innocuité et l'efficacité du vaccin).
Si les gouvernements nationaux ont présenté ce choix comme le signe de leur prudence sanitaire, celui-ci correspond en réalité à un moindre risque d'ordre financier , et non à un moindre risque d'ordre sanitaire , ce dernier étant de toute façon couvert en cas de refus d'AMM.
En fait, le choix européen d'un modèle de précommande, par opposition à un modèle de financement initial du développement, retenu notamment par la Chine, par la Russie et surtout par les États-Unis (cf. infra ), est d'abord un choix par défaut, qui témoigne de la faible capacité de l'Union européenne à investir en amont du développement et de la production , en partageant très tôt les risques avec les entreprises. Cette faiblesse a un prix, qui correspond peu ou prou à l'écart constaté entre les contrats américains et européens.
De fait, un partage des risques sur le modèle américain supposerait une capacité à mobiliser des fonds publics massifs, dans un délai très court et de façon mutualisée, ce qui ne peut se faire que via un instrument financier européen, ou a minima par une coordination très étroite dont il n'existe à ce jour aucun exemple. La crise a indéniablement conduit à une prise de conscience à ce sujet, et à cette première avancée que constitue la mutualisation des achats, mais un chemin important reste à parcourir.
Il serait cependant exagéré d'opposer complètement les deux modèles. En effet, d'une part, et afin de compenser le risque pris par les développeurs des vaccins, des clauses d'indemnisation sont prévues par les contrats européens en cas d'échec du développement ou d'annulation des commandes. Si leur détail n'est pas connu, ces clauses peuvent s'analyser comme une forme de partage du risque par l'acheteur.
D'autre part, et surtout, les contrats d'achat signés par la Commission européenne s'accompagnent d'un préfinancement par l'Instrument d'aide d'urgence (IAU) à hauteur de 2 Md€ (soit 15 % du total), sous la forme d'un acompte sur les commandes à venir, ce qui correspond là aussi à un financement des phases de développement. Volet financier de la « feuille de route européenne pour la levée des mesures de confinement liées à la pandémie de coronavirus » présentée en avril 2020, l'IAU a consacré à l'achat de vaccins la plus grande part de son budget de 2,7 Md€, et a aussi contribué au financement mutualisé de traitements, dont le remdesivir (63 M€ cf. infra ), de tests antigéniques (100 M€), d'équipements de protection (masques, blouses, etc.), d'opérations de transport de patients et d'équipes (médicales), de formations, d'études médicales ou encore d'applications informatiques. Ainsi, quoique sans commune mesure avec les moyens américains, l'Instrument d'aide d'urgence est un premier pas encourageant vers la mutualisation des risques, des efforts et des stratégies face à la menace épidémique.
En outre, des instruments tels que la Banque européenne d'investissement (BEI) peuvent être mobilisés - comme ce fut le cas pour le prêt de 100 M€ accordé à l'entreprise allemande BioNTech le 11 juin 2020 et pour le prêt de 75 M€ accordé à CureVac le 6 juillet 2020, la piste innovante de l'ARNm étant alors jugée suffisamment prometteuse.
d. Le prix de la sécurité sanitaire ?
Comme l'ont fait la plupart des pays face à la pandémie de Covid-19, l'Agence européenne du médicament (EMA) fait le choix d'une procédure accélérée en vue de la délivrance d'une autorisation de mise sur le marché (AMM), et du recours à la procédure d'évaluation en continu ( rolling review ) des résultats. Utilisée pour accélérer l'évaluation d'un traitement prometteur lors d'une urgence sanitaire, cette procédure permet au comité d'évaluation d'examiner les données au fur et à mesure de leur disponibilité, alors qu'habituellement, un laboratoire qui dépose une demande d'AMM doit fournir l'ensemble des données lors du dépôt de la demande (études précliniques et trois phases des études cliniques).
Toutefois, les critères de qualité, d'innocuité et d'efficacité restent strictement identiques à ceux de la procédure de droit commun. À l'issue de la rolling review , l'EMA peut accorder une autorisation conditionnelle de mise sur le marché, qui permet son utilisation même si les données sont encore incomplètes. Le vaccin développé par AstraZeneca est le premier avoir bénéficié de cette procédure, lancée le 1 er octobre 47 ( * ) . L'EMA devrait rendre sa première décision le 29 décembre, pour le vaccin de Pfizer-BioNTech.
Le haut degré d'exigence sanitaire du régulateur européen ne constitue pas en tant que tel un désavantage dans les négociations - et quand bien même ce serait le cas, il ne s'agit aucunement de le remettre en cause. En revanche, il est possible que les pays qui, dans le monde, ont opté pour des procédures d'examen encore plus dérogatoires en aient fait - au moins implicitement - un levier de négociation face aux laboratoires, tant l'enjeu est grand, pour ces derniers, de se positionner au plus vite sur le marché.
e. Quelques interrogations de principe sur la stratégie collective
Enfin, et sans pour autant remettre en cause les avantages qu'elle procure, on peut noter que la stratégie commune européenne soulève quelques interrogations de principe :
• s'agissant du prix, au-delà de l'objectif d'obtenir de meilleures conditions en jouant sur les volumes, le principe du prix unique ne tient pas compte, le cas échéant, des différences de pouvoir d'achat entre États-membres. En l'absence d'un mécanisme de péréquation, qui ne semble pas avoir été envisagé, la solidarité européenne en matière d'achat n'est donc pas totale ;
• s'agissant des délais, le principe de la livraison simultanée ne tient pas compte du fait que l'épidémie puisse être plus ou moins avancée selon les États-membres. On peut aussi imaginer que ce principe conduise à retarder une livraison de doses déjà produites, dans l'attente de pouvoir servir l'ensemble des pays en même temps ;
• s'agissant des volumes, la stricte répartition à raison de la population de chaque État-membre ne prend pas non plus en compte le stade d'avancement ni la gravité de l'épidémie, ni le fait que les politiques de santé publique ou la volonté de la population de se faire vacciner puissent être différentes.
Tous ces éléments pourraient aboutir à une gestion sous-optimale des stocks au regard de la situation épidémique . Or, en l'absence de mécanismes d'ajustement et de coordination prévus a priori , il n'est pas certain qu'un État-membre disposant de surplus à un moment donné soit disposé à les céder à un autre.
2. Le Royaume-Uni : une stratégie risquée, sur le plan financier mais aussi sur le plan médical
a. La rapidité, objectif principal d'une stratégie avant tout politique
Au sein de l'Union européenne, certains États-membres ont fait le choix d'une stratégie individuelle. Au-delà du cas de la Hongrie, qui a opté pour le vaccin Spoutnik V développé par l'Institut Gamaleïa de Moscou, c'est surtout la stratégie du Royaume-Uni qui suscite des interrogations.
Le pays a en effet choisi de négocier directement avec les laboratoires, pour un volume total de 357 millions de doses en commandes fermes, auxquelles s'ajoutent 40 millions de doses supplémentaires en option.
Cette stratégie individuelle a permis au Royaume-Uni d'obtenir de commencer sa campagne de vaccination dès le 8 décembre, après avoir été le premier pays à autoriser l'autorisation d'un vaccin le 2 décembre. Les 100 000 premières doses du vaccin Pfizer-BioNTech, fabriquées en Belgique, ont été livrées peu avant le début de la campagne, « plusieurs millions d'autres [devant arriver] courant décembre » selon le secrétaire d'État à la Santé Matt Hancock.
|
Précommandes de vaccins par le Royaume-Uni |
Sources : annonces officielles (en vert) à jour au 13 décembre 2020 pour les volumes. Les prix ne peuvent pas être estimés.
b. Un pari risqué sur le plan financier...
Lors de la conférence de presse du Gouvernement du 3 décembre, le secrétaire d'État chargé des affaires européennes, Clément Beaune, a assuré que le Royaume-Uni n'avait pas retiré d'avantage de sa stratégie individuelle. Si l'on met de côté le « succès » remporté en matière de calendrier, sans doute davantage lié à la rapidité de la procédure d'autorisation qu'aux conditions d'achat elles-mêmes (cf. infra ), il est en effet probable que le Royaume-Uni ait payé ses vaccins au prix fort, le pays ne pouvant pas jouer sur les volumes (357 millions de doses) en comparaison de l'Union européenne et des États-Unis (respectivement 1,3 et 1,1 milliard de doses).
C'est sans doute l'une des raisons pour lesquelles le gouvernement britannique n'a jamais communiqué sur le prix des contrats 48 ( * ) , alors qu'il l'a fait sur les volumes et le calendrier, ainsi que sur ses dépenses en matière de préparation logistique (pour 230 M£, soit 251 M€). Quoique possible, une estimation à partir du prix unitaire payé par l'Europe ou les États-Unis, ou à partir du prix annoncé par deux laboratoires, aboutirait probablement à afficher un coût total en-deçà de la réalité.
Dans ce contexte, il semble que le Royaume-Uni ait utilisé, comme levier de négociation, le volume relatif des commandes au regard des besoins réels de la population. En effet, les commandes fermes dont se prévaut le gouvernement britannique permettent de couvrir 266 % de la population, à raison de deux doses par personnes. Même en prenant en compte une marge de précaution liée aux incertitudes d'ordre médical, ce taux de couverture est largement supérieur à celui des États-Unis (168 %) et des autres pays européens (146 %). Encore ces calculs ne tiennent-ils pas compte du fait qu'un dosage inférieur pourrait s'avérer suffisant. Enfin, la faible part des commandes optionnelles (11 % des commandes fermes, contre 65 % pour les pays européens et 100 % pour les États-Unis) semble également plaider pour une stratégie du risque financier maximal dans les négociations avec les laboratoires pharmaceutiques.
Sauf à ce que la majorité des traitements se révèlent in fine inefficaces ou dangereux, au-delà même du niveau de précaution pris par les États-Unis et les pays européens, cela signifie donc, tout simplement, que le gouvernement britannique aurait donc délibérément passé des commandes excessives pour afficher un succès politique rapide, avec l'intention de les annuler par la suite, faisant supporter au contribuable de demain le coût des indemnités financières dont le citoyen d'aujourd'hui ne se préoccupe guère.
Pour autant, et en dépit de ces remarques, la stratégie britannique ne saurait être considérée comme dénuée de fondement, compte tenu notamment de l'effet psychologique que peut provoquer sur la population l'annonce d'une disponibilité précoce des vaccins.
c. ...mais aussi risqué sur le plan médical
Même en optant pour des commandes fermes très importantes au regard de sa population, la marge de manoeuvre du Royaume-Uni sur les volumes demeure limitée. En réalité, le facteur déterminant de la stratégie britannique semble avoir été l'accélération de la procédure d'autorisation , qui est en soi, et quoique de façon implicite, un argument important dans les négociations avec les laboratoires : ainsi la Medicines and Healthcare Products Regulatory Agency (MHRA) a-t-elle été le premier régulateur au monde à autoriser, le 2 décembre, le vaccin de Pfizer-BioNTech, soit 23 jours seulement après l'annonce des résultats des essais cliniques.
En effet, contrairement aux autres pays européens, qui ont choisi de recourir à la procédure d'AMM conditionnelle centralisée de l'EMA, avec les délais et critères qu'elle suppose, le Royaume-Uni a opté pour une procédure dérogatoire d'autorisation en urgence au niveau national, sans attendre l'issue des procédures européennes.
Il s'agit là d'un point particulièrement délicat de la stratégie britannique, puisqu'au risque financier s'ajoute un risque médical assumé , et par conséquent un risque de perte de confiance des citoyens. Or il est très difficile de distinguer, dans la décision britannique, entre ce qui relève de considérations d'ordre purement médical (c'est-à-dire l'arbitrage bénéfice-risque compte tenu de l'urgence et des connaissances scientifiques) et ce qui relève de considérations politiques (être le premier pays au monde à autoriser un vaccin puis à protéger sa population) et économiques (faire baisser les prix).
Même si l'avis du régulateur européen pourrait in fine s'avérer conforme à l'autorisation donnée par la MHRA, l'EMA et plusieurs États-membres ont manifesté publiquement leur désapprobation, appelant chacun à s'en tenir aux procédures en cours au niveau européen. Ceci doit être l'occasion de rappeler que, contrairement à ce qui a été soutenu par certains responsables politiques britanniques, la procédure utilisée par le Royaume-Uni n'est en aucune manière liée au Brexit . Soumis au droit de l'UE jusqu'au 31 décembre 2020, le Royaume-Uni a en effet utilisé une procédure dérogatoire prévue par les textes, qui permet à un État-membre, en cas d'urgence, d'autoriser un traitement à titre temporaire et sur son seul marché intérieur, sans attendre l'autorisation de l'EMA. Cette autorisation d'urgence, fondée sur des données partielles, n'est pas une AMM, ni même une AMM conditionnelle.
3. Les États-Unis : une stratégie complète dont l'Europe doit faire son ambition
a. Des conditions financières avantageuses et une livraison prioritaire
Les préfinancements accordés par le Gouvernement américain à partir de mars 2020 dans le cadre de l'Opération Wrap Speed , à hauteur de plus de 10 Md$ (8,2 Md€), ont non seulement permis aux États-Unis de sécuriser près de 1,1 milliard de doses et un volume identique en option, mais aussi de s'assurer une priorité dans la livraison, pour au moins 40 millions de doses avant la fin de l'année 2020. La campagne de vaccination devrait débuter le 14 décembre, suite à l'autorisation accordée le 11 décembre au vaccin de Pfizer-BioNTech par la Food and Drugs Administration (FDA).
|
Préfinancement de vaccins par les États-Unis (Opération Wrap Speed ) |
Sources : annonces officielles (en vert) à jour au 13 décembre 2020 pour les volumes et les montants totaux, et estimations OPECST pour les prix unitaires.
Bien que la situation sanitaire du pays soit par ailleurs très préoccupante et que des incertitudes demeurent quant au volet logistique de la campagne vaccinale, force est donc de constater que, sur le plan économique et financier, comme s'agissant du calendrier, la stratégie américaine a remporté un succès important .
Or - et c'est le point le plus important - les États-Unis n'ont bénéficié d'aucun avantage à raison des volumes commandés : en effet, les commandes fermes passées par les États-Unis (1,1 milliard de doses) sont inférieures à celles passées par les pays européens (1,3 milliard de doses), ce qui n'a pas empêché les États-Unis de payer moins cher, soit environ 7,50 € par dose 49 ( * ) (9,18 $), contre une estimation de 9 € par dose pour les Européens.
Il faut donc chercher l'explication du succès américain dans d'autres facteurs que le seul volume des commandes - facteurs qui témoignent en creux des progrès que doit encore accomplir l'Union européenne, au-delà de ses avancées récentes.
b. Payer « cash », payer tôt et payer pour tout : les clés du succès des États-Unis
Les principales forces de la stratégie américaine pourraient être résumées ainsi : la capacité de l'État fédéral à assumer une part importante du risque par des investissements massifs, précoces et sur l'ensemble de la chaîne - un risque que l'UE n'est pas en mesure d'assumer, et un risque qu'il convient de bien distinguer de celui pris par le Royaume-Uni, certes important sur le plan financier comme sur le plan sanitaire, mais qui ne fait finalement que compenser une réaction assez tardive et un pouvoir de négociation réduit sur les volumes.
Plus précisément, la stratégie américaine a été guidée par trois principes : payer « cash », payer tôt, et payer pour l'ensemble de la chaîne.
i. Payer « cash » : investir dans le développement initial
Financer l'investissement initial de développement du vaccin permet de partager le risque d'échec avec l'entreprise, cet investissement initial donnant ensuite droit, en cas de réussite, à un certain nombre de doses pour une valeur définie 50 ( * ) : c'est l'option retenue par la BARDA aux États-Unis (cf. infra ), qui a directement investi plus de 10 Md$ dans le développement de sept vaccins prometteurs contre le coronavirus dans le cadre de l'Opération Wrap Speed . Ainsi, par exemple, la seule entreprise Moderna a bénéficié d'un contrat de 955 M$ couvrant sans contrepartie « 100 % des coûts supportés par l'entreprise pour conduire le programme » de recherche et développement, puis ensuite d'un contrat d'achat de 100 millions de doses pour 1,5 Md$, soit près de 2,5 Md$ au total.
Le partage du risque est ainsi bien différent de celui qui résulte du modèle européen de précommandes (cf. supra ), et constitue probablement la principale explication de la différence constatée sur le prix final.
ii. « Payer tôt » : investir au state des premiers essais cliniques
Corollaire du point précédent, la précocité de l'investissement confère un avantage dans les négociations, notamment pour l'accès aux premières doses effectivement produites. À cet égard, on rappellera que les premiers financements américains ont été accordés dès le mois de mars 2020, en l'occurrence au laboratoire Johnson & Johnson pour 456 M$. En avril, Moderna a reçu un premier financement de 483 M$ alors que son vaccin était encore en phase I des essais cliniques.
Par contraste, la Commission européenne a attendu le 27 août, soit cinq mois plus tard, pour signer avec AstraZeneca le premier de ses six contrats d'approvisionnement, suivant de peu les premiers contrats signés par le Royaume-Uni, le 14 août avec les laboratoires Janssen et Novavax. Le dernier contrat signé par la Commission européenne, avec Moderna, date du 25 novembre dernier.
iii. « Payer pour tout » : investir dans la production et la distribution
À partir de juillet 2020 (contrat de 450 M$ avec Regeneron), les États-Unis ont commencé à octroyer des financements couvrant l'ensemble de la chaîne de production, c'est-à-dire le développement, la fabrication et le cas échéant la distribution des vaccins. Par ces financements, le gouvernement américain assume une part plus importante encore du risque pris les acteurs privés, cette fois sur le volet industriel (construction des usines, etc.).
Ces financements ont bénéficié à la fois aux laboratoires développant les vaccins et, pour près d'un milliard de dollars, à des sites de production industriels sur le territoire américain (Emergent BioSolutions, Texas A&M et Fujifilm, GRAM, Cytiva, etc.).
L'Union européenne, quant à elle, ne dispose pas d'une telle capacité à investir dans l'outil de production. Seuls les États-membres peuvent le cas échéant agir à leur niveau, avec des moyens nécessairement plus limités et moins coordonnés, et de surcroît contraints par les règles communautaires en matière d'aides d'État (cf. infra ).
c. Un risque financier mais pas sanitaire
Certes, le choix de recourir à la procédure de l'autorisation temporaire d'urgence a sans doute également joué un rôle dans le succès de la stratégie américaine, la FDA ayant été en mesure d'autoriser le vaccin de Pfizer-BioNTech seulement trois semaines après le dépôt de la demande, effectué le 20 novembre. Toutefois, même si cela peut expliquer la légère avance prise par les Américains, selon les propos de la directrice de l'EMA, Emer Cooke, elle-même 51 ( * ) , les travaux du régulateur américain ont suscité bien moins de critiques que ceux de son homologue britannique, sur le plan de la rigueur de l'évaluation comme de la transparence à l'égard du public.
En outre, les investissements des États-Unis ont été accordés en contrepartie d'un droit de regard du gouvernement fédéral sur les protocoles sanitaires de chaque laboratoire, alors qu'habituellement ceux-ci peuvent les fixer librement. Ce contrôle semble avoir été effectivement exercé, ce qu'a pris en compte la FDA dans sa procédure d'examen.
En réalité, la stratégie américaine de financement précoce repose bien sur la prise d'un risque financier, et non d'un risque sanitaire : si l'UE avait été en capacité d'investir en amont, elle aurait éventuellement perdu de l'argent, mais n'aurait pas mis en danger la santé de sa population. N'ayant pu investir plus tôt, elle achète plus cher les mêmes vaccins.
d. La BARDA : un modèle à suivre pour l'Union européenne
La stratégie américaine a été menée dès l'origine au niveau fédéral, dans le cadre de l'Opération Wrap Speed , placée sous l'autorité directe du secrétaire d'État à la Santé et du secrétaire d'État à la Défense, et dont l'objectif initial était la distribution de 300 millions de doses d'ici janvier 2021 52 ( * ) .
Son acteur-clé est la Biomedical Advanced Research and Development Authority (BARDA) , une agence fédérale créée en 2006 dans un contexte de préparation aux menaces bioterroristes, et responsable de la préparation du pays aux risques sanitaires au sens large, dont les pandémies d'origine infectieuse, mais aussi les risques nucléaires, radiologiques, biologiques et chimiques (NRBC). À cette fin, la BARDA dispose d'un budget important pour investir directement dans les entreprises, via des partenariats public-privé, afin de financer l'innovation, la recherche avancée et le développement de « contremesures » médicales (traitements, vaccins, outils de diagnostic, etc.), et pour constituer des stocks stratégiques au niveau fédéral. Ceux-ci contribuent à assurer la viabilité du marché sur le long terme.
L'Opération Wrap Speed comporte trois volets, que la crise actuelle a imposé de mener simultanément, ce qui souligne le besoin d'une coordination centralisée et d'une capacité d'investissement forte et précoce : un volet « développement », avec plus de 10 Md$ investis dans le développement de sept vaccins prometteurs contre le coronavirus 53 ( * ) ; un volet « fabrication », avec un investissement dans l'outil industriel (cf. partie III infra ), sur le territoire américain, pour garantir un approvisionnement aussi rapide que possible et, à plus long terme, pour contribuer à l'autonomie stratégique des États-Unis en la matière ; un volet « distribution », le démarrage rapide de la campagne de vaccination devant beaucoup à l'effort de préparation réalisé en amont, notamment via des investissements publics dans la chaîne de distribution. En Europe, un effort de coordination et, dans une moindre mesure, d'investissement a également été réalisé, mais au niveau de chaque État-membre.
L'exemple américain a conduit la Commission européenne, par la voix de la commissaire à la Santé Stella Kyriakides, à appeler le 12 novembre dernier à la création d'une « BARDA européenne », la Health Emergency Response Authority (HERA), qui serait en mesure de nouer des partenariats public-privé pour investir en amont dans la recherche et le développement de traitements, mais aussi de constituer des stocks stratégiques au niveau européen. Une proposition formelle sera faite en ce sens fin 2021, et l'agence pourrait voir le jour en 2023. L'OPECST ne peut que soutenir cette initiative , tout en soulignant que si une telle structure devait voir le jour, et compte tenu du fait qu'elle aurait sans doute des moyens plus modestes que son homologue américaine, sa création ne devrait pas se faire au détriment de la capacité des États-membres à investir individuellement .
Recommandation Doter l'Union européenne d'une agence sur le modèle de la BARDA américaine, capable d'investir massivement, sous la forme de partenariats public-privé, dans le développement initial et la production de médicaments stratégiques, et chargée de constituer des stocks mutualisés au niveau européen.
Dans l'attente de la création d'une telle agence, qui fait partie du projet plus large d'une « Union de la Santé », avec toutes les incertitudes supplémentaires que cela implique 54 ( * ) , il importe toutefois de ne pas affaiblir les mécanismes ad hoc qui se sont mis en place à la faveur de la crise.
Recommandation Pérenniser l'Instrument d'aide d'urgence (IAU) sous la forme d'un fonds d'investissement d'urgence européen, alimenté par les États-membres et disposant, en cas de crise sanitaire, de la capacité d'intervenir immédiatement et massivement pour soutenir le développement initial et la production des médicaments.
Enfin, doter l'Union européenne d'une capacité à investir en développement n'exclut pas de renforcer la coordination en matière d'achats qui a montré ses vertus. De fait, le pouvoir de négociation des pays européens ne pourra que s'accroître au fil des expériences, qui constituent autant de « précédents » auxquels se référer.
Recommandation Pérenniser la politique européenne de mutualisation des achats de médicaments stratégiques et autres dispositifs médicaux, grâce à une équipe dédiée associant la Commission européenne et des experts issus des États-membres qui le souhaitent.
B. STRATÉGIE VACCINALE ET STRATÉGIE ACHATS : DEUX LOGIQUES EN PARTIE AUTONOMES
1. La bonne gestion des deniers publics : une exigence valable en temps de crise
La question du coût de la campagne de vaccination est politiquement inaudible à court terme, d'abord en raison du contexte anxiogène lié à la crise sanitaire, et ensuite parce que la vaccination sera entièrement financée par la Sécurité sociale, donc en apparence « gratuite », un choix qui n'est pas contestable en tant quel. Acheter des vaccins à un prix avantageux a pourtant un intérêt majeur, ne serait-ce que pour pouvoir en acheter davantage et pour ne pas compromettre d'autres politiques publiques, et la question budgétaire ne manquera pas de se rappeler au bon souvenir des responsables politiques une fois la crise sanitaire passée. Cela n'est en rien spécifique à la France ; le « pari » de Boris Johnson est ainsi un exemple de préférence pour le court terme.
À cet égard, s'il est parfaitement normal qu'une situation de crise s'accompagne de surcoûts, encore faut-il distinguer clairement entre :
• d'une part, ce qui relève de la « stratégie vaccinale » stricto sensu , placée sous la responsabilité des autorités sanitaires : face aux incertitudes liées l'apparition d'une maladie infectieuse nouvelle pour laquelle des traitements à apparaissent au fur et à mesure, et dont l'efficacité au début incertaine est plus ou moins confirmée avec le temps, le principe de précaution peut aboutir à des surcoûts légitimes, par exemple via des achats massifs et diversifiés de vaccins pour parer à toute éventualité ;
• d'autre part, ce qui relève spécifiquement de la « stratégie achats », c'est-à-dire de la bonne gestion des deniers publics : compte tenu des connaissances scientifiques à un moment donné et des exigences de délai, relevant de la seule compétence des autorités sanitaires , il est de la responsabilité des acheteurs publics de privilégier la solution la moins onéreuse parmi celles qui sont disponibles.
Il est beaucoup trop tôt pour évaluer le coût total de la campagne de vaccination, dont les achats de vaccins ne représentent qu'une partie Si la comparaison a ses limites, on rappellera pour mémoire que, lors de l'épidémie de H1N1 en 2009, le coût total de la campagne de vaccination évalué par la Cour des comptes 55 ( * ) était environ 700 M€, soit compte tenu de la population effectivement vaccinée (5,4 millions de personnes) un coût de 110 € par personne vaccinée. Les achats de vaccins représentaient environ la moitié du coût total de la campagne.
Plus précisément, la France avait initialement acquis quelque 94 millions de doses, pour un montant de 712 M€, soit 7,57 € par dose 56 ( * ) . L'annulation subséquente de 50 millions de doses avait ramené le coût final de l'achat des vaccins à 383 M€, dont 49 M€ au titre de l'indemnisation des laboratoires pour les commandes annulées.
À ce jour, les sommes prévues pour les seuls achats de vaccin, soit environ 1,8 Md€, excèdent d'ores et déjà largement les sommes engagées en 2009-2010 et même le coût total de la campagne de vaccination, ce qui pose une série de questions, s'agissant à la fois de la répartition entre les vaccins commandés et du volume total des commandes.
Au préalable, il convient de rappeler que le prix du médicament lui-même est en tout état de cause fixé librement par le laboratoire, compte tenu de sa politique commerciale et des conditions de concurrence, et qu'il n'existe aucune règle contraignante liant le prix à l'efficacité (relative ou absolue) du traitement. Les États sont libres d'accepter ou non les conditions proposées - ce qu'ils font dans un contexte d'urgence et sur la base de données cliniques partielles.
2. Le prix relatif des différents vaccins : un sujet tabou ?
Dans la présentation de sa stratégie vaccinale, le Gouvernement a fréquemment évoqué la question du prix négocié avec les laboratoires pharmaceutiques sous l'angle des volumes commandés (acheter à plusieurs permet d'obtenir des prix plus bas), comme l'ont fait notamment Agnès Pannier-Runacher et Clément Beaune lors de la conférence de presse du 3 décembre, mais jamais sous l'angle du prix relatif des différents traitements ( commander le vaccin le moins cher pour une efficacité comparable), qui reste un sujet largement tabou.
Or il existe une différence de prix substantielle entre les différents vaccins (environ 3 € pour une dose du vaccin AstraZeneca, contre environ 15 € pour le vaccin Pfizer-BioNTech, soit une différence de 1 à 5 ), pour une efficacité dans certains cas comparable , ou du moins pour une différence d'efficacité acceptable en fonction de la population-cible 57 ( * ) . Il faut ajouter à cela les coûts liés à la logistique et à la conservation , qui se trouvent être plus élevés pour les vaccins les plus chers - le vaccin Pfizer-BioNTech doit ainsi être conservé à -70°C et est conditionné en flacons multidoses.
À mesure que seront publiés les résultats des études cliniques, les gouvernements pourraient être amenés à revoir la part de chaque vaccin au sein de leur portefeuille, du moins si les contrats le permettent dans des conditions acceptables. Dans le cas contraire, il y aura lieu de s'interroger sur la stratégie de négociation retenue à l'origine.
Ces remarques ne remettent nullement en cause le choix initial d'un portefeuille diversifié, y compris avec des écarts de coûts très importants entre chaque vaccin, choix qui demeure pertinent tant que demeurent des incertitudes d'ordre médical. De plus, il est normal qu'un vaccin innovant (vaccins à ARN) coûte plus cher qu'un vaccin traditionnel, compte tenu des investissements initiaux nécessaires - quoiqu'un acheteur (l'Union européenne) n'ait pas le même intérêt à supporter ces coûts qu'un investisseur (les États-Unis).
3. Pourquoi commander 200 millions de doses ?
S'agissant du volume total des commandes, les pays occidentaux ont acheté bien au-delà ce qui est nécessaire à la couverture vaccinale de l'ensemble de leur population , soit pour rappel 146 % de la population française et européenne, 168 % de la population américaine, et jusqu'à 266 % pour la population britannique, en retenant les seules commandes fermes et en faisant l'hypothèse conservatrice de deux doses par personne.
À l'instar du choix entre différentes solutions, la décision concernant le volume total de doses à commander obéit d'abord à des considérations médicales : il s'agit de prendre toutes les précautions nécessaires, tant que demeurent des incertitudes sur l'efficacité réelle des vaccins, commandés en amont de l'AMM, sur leur fabrication, sur l'approvisionnement et sur la logistique, y compris jusqu'en bout de chaîne (pertes liées aux conditions de conservation et au conditionnement en plusieurs doses). Même si les critères retenus pour la fixation des volumes ne sont pas connus dans le détail, la prudence du Gouvernement semble donc justifiée à ce stade.
Il reste que, dans un second temps, les considérations économiques prendront toute leur place, à mesure que seront levées les incertitudes liées à l'efficacité clinique des vaccins et à l'approvisionnement. La question n'est donc pas de savoir s'il faut ou non être prudent - sur le principe, cela ne fait pas de doute - mais plutôt de savoir dans quelle mesure il faut l'être, et surtout dans quelle mesure il est possible d'ajuster les commandes initiales pour tenir compte de l'évolution de la situation et des connaissances, ce qui pose une fois de plus la question des clauses contractuelles.
On rappellera à cet égard le précédent du remdesivir, développé par le laboratoire Gilead : suite aux résultats décevants de l'étude Solidarity menée dans 30 pays, l'OMS s'est finalement prononcée le 20 novembre 2020 contre le recours à cette molécule en traitement des patients atteints du Covid-19, quelle que soit la gravité de leur état, une position suivie par l' European Society of Intensive Care Medicine le 13 novembre 2020 58 ( * ) . Or l'UE avait conclu le 7 octobre 2020 un contrat-cadre portant sur la possibilité pour 37 pays de commander jusqu'à 500 000 doses de remdesivir, pour un montant global de plus d'un milliard d'euros, en plus du contrat de 63 M€ financé par l'Instrument d'aide d'urgence (IAU) (cf. supra ), et alors que le laboratoire avait déjà connaissance de l'inefficacité du traitement 59 ( * ) . La France est le seul pays majeur à ne pas avoir passé commande au titre du contrat-cadre. Sur les neuf premiers mois de 2020, le remdesivir a déjà rapporté près de 900 M$ à Gilead, au prix unitaire de 390 $ la dose (soit 2 340 $ le traitement).
En faisait l'hypothèse - certes maximaliste - du paiement effectif de l'ensemble des doses de vaccins ayant fait l'objet de commandes fermes, sans annulation de la part de l'une ou l'autre partie, on peut estimer le coût par personne de l'achat des vaccins : 24,50 € par personne en France et en Europe, 30,80 € par personne aux États-Unis , et sans doute davantage encore au Royaume-Uni. Ce coût correspond au prix de l'ensemble des doses commandées par un pays rapporté à sa population, et reflète directement le niveau de « précaution » (ou de risque financier) pris par chaque gouvernement 60 ( * ) . Si le montant est amené à évoluer au cours des prochains mois, en fonction des doses effectivement livrées et des personnes effectivement vaccinées, c'est bien cet indicateur qui permettra in fine d'apprécier la viabilité budgétaire de la stratégie vaccinale retenue, du moins pour le volet « achats de vaccins ».
4. La question des clauses d'annulation, d'indemnisation et de responsabilité
a. Les clauses d'annulation et d'indemnisation liées à l'achat des vaccins
La pertinence économique et financière de la stratégie vaccinale du Gouvernement est donc tributaire des clauses contractuelles négociées par la task force avec les fournisseurs, notamment en matière d' annulation ou de rétractation , que les États pourraient devoir invoquer, dans le cas où l'évolution de l'épidémie rendrait inutiles un certain nombre de doses (recul des contaminations, protection collective atteinte, changement de posologie etc.) - d'où une modification du volume total du portefeuille de vaccins - ou dans le cas où un vaccin moins cher ou plus efficace serait disponible ailleurs - d'où une modification de la répartition des vaccins au sein du portefeuille.
Sur ce dernier point, Agnès Pannier-Runacher s'est montrée évasive lors de la conférence de presse du 3 décembre, renvoyant la responsabilité d'une telle décision aux seules autorités sanitaires - ce qui revient à envisager la seule possibilité qu'un nouveau vaccin puisse être plus efficace (décision médicale), mais pas qu'un nouveau vaccin puisse être moins cher tout en ayant une efficacité comparable voire supérieure (décision économique).
Même si les négociations européennes se sont déroulées dans des conditions très différentes de celles menées par la France en 2009, le précédent de la crise de la grippe H1N1 confirme qu'il s'agit d'une préoccupation légitime. Ainsi, comme l'observe la Cour des comptes dans un référé de septembre 2010, « il n'existe dans les contrats aucune disposition décrivant les conditions économiquement prédéfinies dans lesquelles une fraction des 94 millions de doses aurait pu être annulée, soit au vu des caractéristiques cliniques de la pandémie, soit en cas de désajustement entre son cycle et le calendrier de fourniture du vaccin, soit enfin dans le cas d'une posologie définitive ne justifiant qu'une dose. On n'y trouve pas davantage de “clause de renégociation” de nature à faire évoluer le contrat en fonction de la réalité des besoins ».
Aux clauses d'annulation et de renégociation s'ajoutent les clauses de responsabilité et d' indemnisation , relatives d'une part à l'indemnisation des laboratoires en cas d'annulation par les États, et d'autre part à l'indemnisation des États en cas d'incapacité des laboratoires à fournir les doses dans les délais, quantités, formats et niveaux de qualité convenus. Il s'agit d'une préoccupation majeure, compte tenu de la concurrence que se livrent les pays pour être servis en priorité, et des problèmes logistiques d'ores et déjà annoncés par les laboratoires (Pfizer-BioNTech et Sanofi ont déjà annoncé d'importants retards).
S'agissant des contrats négociés en 2009, la Cour des comptes précise qu'« en même temps qu'ils s'assuraient des commandes fermes, les producteurs ont obtenu de ne prendre aucun engagement sur les délais de livraison, ne consentant à ne faire apparaître dans les contrats que des calendriers purement indicatifs. L'absence de pénalités de retard était la conséquence logique de cette position ».
b. Les clauses responsabilité en cas de problème médical
La question de la responsabilité des laboratoires en cas de problèmes d'efficacité ou d'innocuité apparaissant au cours d'études ultérieures est d'autant plus importante que les vaccins font l'objet d'autorisations temporaires d'usage et sont évalués sur des données partielles.
Sur ce dernier point, les représentants des laboratoires pharmaceutiques ont fait valoir la confidentialité des contrats au titre du secret des affaires. La Commission européenne n'est pas plus explicite, rappelant qu'« afin de compenser les risques élevés pris par les fabricants, les contrats d'achat anticipé prévoient que les États membres indemnisent le fabricant pour les responsabilités encourues dans certaines conditions. La responsabilité reste endossée par les sociétés ».
La France - contrairement à d'autres États-membres - dispose d'un cadre légal encadrant la responsabilité civile des laboratoires, y compris de façon extracontractuelle, et d'un mécanisme public d'indemnisation, l'ONIAM, créé par loi du 4 mars 2002 relative aux droits des malades et à la qualité du système de santé (cf. axe 2 sur ce point).
Ce cadre ne permet toutefois pas de couvrir l'ensemble des situations, et la question des clauses de responsabilité demandées par les laboratoires dans les contrats est d'autant plus légitime qu'il existe un précédent, relevé par la Cour des comptes au sujet des contrats passés lors de l'épidémie de H1N1, qui fait écho à maints égards à la crise actuelle : « les pouvoirs publics ont ensuite mené dans le secret et l'urgence des négociations sans précédent avec ces laboratoires pharmaceutiques, en privilégiant deux objectifs : d'une part le retrait d'une clause dite “scélérate” de transfert de responsabilité à l'État, d'autre part des engagements sur des calendriers de livraison anticipés afin de soutenir la comparaison avec les britanniques, alors que ces calendriers n'avaient qu'une valeur indicative et qu'ils n'ont pas été respectés. Ces deux priorités ont amoindri les marges de négociations de l'État qui a cédé sur la contrainte de prix, sur le fait d'effectuer une commande ferme et non par tranches conditionnelles ainsi que sur le conditionnement des vaccins en monodoses et non en multidoses, exigence qui n'a d'ailleurs pas été explicitement formulée ».
c. Les causes de confidentialité des contrats
Dans ce contexte, plusieurs voix se sont élevées pour demander la publicité des clauses des contrats négociés avec les laboratoires pharmaceutiques, à l'instar de Pascal Canfin, président de la commission de l'environnement, de la santé publique et de la sécurité alimentaire du Parlement européen, ou encore de l'ONG Médecins sans frontières (MSF). Une telle publicité semble toutefois difficile à envisager au stade des négociations, sauf à compromettre le bon déroulement de celles-ci, couvertes par le secret des affaires. La publicité pourrait d'ailleurs se faire au détriment des acheteurs publics : dès lors qu'ils « cèdent » à un producteur, ses concurrents sont incités à augmenter leur prix à leur tour.
En revanche, il pourrait être envisagé d'imposer la publicité a posteriori de certaines clauses contractuelles , c'est-à-dire une fois l'épidémie terminée (selon des critères objectifs à déterminer). Une telle mesure, qui devrait être prise au niveau européen et pourrait prendre la forme d'un registre public des contrats d'approvisionnement passés par les autorités sanitaires avec les laboratoires pharmaceutiques, permettrait aux États ou à la Commission européenne de négocier les prochains contrats en connaissance de cause, y compris dans un contexte d'urgence tel qu'une pandémie. Cette publicité pourrait n'être que partielle et ne concerner que certaines clauses, ou encore ne pas s'appliquer aux contrats antérieurs.
Recommandation Instituer un registre public européen des contrats signés par les États-membres ou la Commission européenne pour la fourniture de produits pharmaceutiques. Les contrats échus y seraient librement consultables dans des conditions et après un délai à définir.
Si les négociations de 2009 se sont déroulées dans un cadre juridique différent, purement national et par ailleurs dérogatoire au code des marchés publics, ce qui doit inviter à la plus grande prudence, on notera que le secret commercial invoqué alors par les laboratoires et l'administration avait des fondements fragiles. Saisie du refus de communication opposé par l'EPRUS à des journalistes, la Commission d'accès aux documents administratifs (CADA) avait en effet rappelé, dans son avis du 8 octobre 2009, « qu'une fois signés, les marchés publics et les documents qui s'y rapportent sont considérés comme des documents administratifs soumis au droit d'accès institué par la loi du 17 juillet 1978 », et que les contrats passés étaient, en l'espèce, « susceptibles de comporter des indications relevant du secret en matière industrielle et commerciale mais non d'être couverts, de manière générale, par les restrictions au droit de communication prévues pour protéger la sûreté de l'État, la sécurité publique ou la sécurité des personnes ». En conséquence, la CADA estimait que « de telles informations ont vocation à être portées à la connaissance de tous dans le cadre d'une politique de santé publique transparente ».
C. LA PRODUCTION DE VACCIN EN EUROPE : ENTRE URGENCE MÉDICALE ET SOUVERAINETÉ SANITAIRE
1. Pour la Covid-19, une fabrication des vaccins qui semble assurée en Europe
Parmi les dilemmes habituellement posés par une crise sanitaire se trouve celui qui oppose l'urgence médicale (quitte à dépendre d'autres pays) à la souveraineté sanitaire (s'assurer de disposer à l'avenir des traitements stratégiques), cette dernière impliquant un effort important d'investissement en amont. De fait, la sécurisation des approvisionnements en vaccins dépend en partie des capacités industrielles de fabrication sur les territoires français et européen - surtout si des difficultés logistiques ou des contraintes de conservation particulières s'ajoutent à la tension sur la demande.
Pour ce qui est des vaccins contre la Covid-19, du moins, le dilemme entre urgence et souveraineté ne semble pas se poser à court terme. La ministre déléguée chargée de de l'Industrie, Agnès Pannier-Runacher, a ainsi précisé le 3 décembre au sujet des commandes signées par la Commission européenne que « la quasi-totalité des vaccins seront fabriqués en Europe, dont une partie en France ».
Si l'on peut regretter ce relatif manque de précision quant à la part française, il convient de préciser que, d'une part, une fabrication « 100 % française » n'aurait pas grand sens compte tenu de l'éclatement de la chaîne de production pharmaceutique en de multiples étapes (production du vaccin et des adjuvants, conditionnement en flacons, etc.) et que, d'autre part, la gestion de l'urgence liée à la crise sanitaire est difficilement compatible avec un recensement exhaustif des capacités de production sur le territoire national, lesquelles évoluent de surcroît rapidement. Il convient donc de raisonner au niveau européen.
Or l'Europe semble plutôt bien positionnée pour l'instant : les premières doses du vaccin Pfizer-BioNtech livrées au Royaume-Uni et même une partie de celles livrées aux États-Unis sont ainsi fabriquées sur le territoire européen, plus particulièrement sur le site de Puurs en Belgique (près d'Anvers), dont les capacités de production atteindraient 50 millions de doses d'ici fin 2020 et 1,3 milliard de doses en 2021. Sans prétendre à l'exhaustivité, on mentionnera aussi les sites de production de la société ROVI en Espagne, de la société Lonza en Suisse ou encore du chimiste allemand Wacker à Amsterdam.
S'agissant de la France, le sous-traitant Delpharm a été retenu par Pfizer-BioNTech pour le conditionnement en flacons stériles de « plusieurs dizaines de millions de doses » de son vaccin dans son usine de Saint-Rémy-sur-Avre (Eure-et-Loir). La chaîne de production, qui a nécessité quelque 10 M€ d'investissements et le recrutement de 40 à 60 personnes, sera opérationnelle à partir d'avril 2021 61 ( * ) . Le sous-traitant Récipharm conditionnera quant à lui le vaccin de Moderna dans son usine de Monts (Indre-et-Loire). Le façonnier luxembourgeois Fareva fabriquera pour sa part les flacons du vaccin de la société CureVac sur ses sites de Pau et de Val-de-Reuil.
2. La dépendance stratégique de l'Europe en matière de médicaments et la question plus large de l'attractivité économique du territoire
Au-delà des vaccins contre la Covid-19, la situation est plus préoccupante, compte tenu de la dépendance de l'Europe en matière de médicaments, notamment vis-à-vis des pays à bas coûts que sont la Chine (pour les principes actifs) et l'Inde (pour les produits finis). Si le problème n'est pas récent, la crise actuelle en a fourni une nouvelle illustration, notamment avec les pénuries de curares et d'anesthésiques lors de la première vague, ou des craintes sur le paracétamol.
Selon l'ANSM, quelque 538 médicaments d'intérêt thérapeutique majeur ont connu une pénurie en 2017 , soit douze fois plus qu'il y a dix ans , ce que déplorait déjà le Sénat dans le rapport de la mission d'information de 2018 sur la pénurie de médicaments et de vaccins 62 ( * ) . Des antibiotiques très utilisés comme l'amoxicilline, des antidouleurs comme l'aspirine et le paracétamol, les vaccins contre l'hépatite B, ou encore des anticancéreux vitaux comme le busultan et l'acide zolédronique, sont régulièrement touchés 63 ( * ) . En février 2020, le ministre de l'Économie, des Finances et de la Relance, Bruno Le Maire, déclarait ainsi : « nous ne pouvons pas continuer à dépendre à 80 % ou 85 % de principes actifs pour les médicaments qui sont produits en Chine, ce serait irresponsable et déraisonnable ». Les États-Unis font face à un problème similaire : 80 % des antibiotiques utilisés dans le pays sont fabriqués en Chine.
Dans ce contexte, la restauration de l'attractivité du territoire français et européen pour la production pharmaceutique constitue un enjeu majeur, qui excède toutefois le cadre de du présent rapport. En effet, d'après le Leem, la France est passée du 1 er rang européen en matière de fabrication de médicaments entre 1995 et 2008 au 4 ème rang aujourd'hui, pour une valeur de 21 Md€, derrière la Suisse, l'Allemagne et l'Italie ; elle est suivie de près par l'Irlande et le Royaume-Uni. Le territoire français compte 271 sites de production et emploie près de 43 000 salariés, soit 43 % du total des effectifs du secteur pharmaceutique.
De façon plus préoccupante, la France ne semble pas positionnée en priorité sur les médicaments les plus indispensables (22 % des médicaments remboursés sont produis en France, contre 50 % des médicaments non remboursés, et 27 % des vaccins), ni sur les traitements les plus innovants (sur les 61 AMM européennes délivrées en 2019, seules 5 concernaient un médicament produit en France, tandis que la moitié des emplois de production en France concerne des médicaments dont le brevet est expiré).
Les principaux pays de production pharmaceutique en Europe (2010-2017)
Sources : LEEM, novembre 2020.
Dans ce contexte, le Leem a présenté dix propositions le 18 novembre 2020 afin de « relancer la compétitivité et l'attractivité de la production de médicaments en France » et « retrouver une autonomie stratégique », parmi lesquelles une baisse de la fiscalité (dispositif de suramortissement, élargissement du crédit d'impôt recherche et du statut de la jeune entreprise innovante, etc.), un accès plus important à des financements publics (fonds d'investissement dédié), une commande publique facilitée (introduction d'un critère d'origine) ou encore un assouplissement de la réglementation, notamment dans l'objectif d'une plus grande polyvalence des usines - ce qui permettrait en effet, dans une situation de crise, d'adapter plus rapidement l'outil de production. On pourrait y ajouter l'enjeu de la formation, signalé par les sous-traitants chargés de la production des vaccins contre la Covid-19, qui peinent à recruter en France des profils qualifiés.
On observera que les mesures proposées sont de nature essentiellement incitative et qu'elles s'appuient sur des comparaisons opportunément limitées aux pays européens. Aussi sont-elles d'abord, pour les entreprises, un outil de mise en concurrence des pays riches entre eux, qui n'apporte pas de réponse au problème de la concurrence des pays à bas coût .
3. Le lieu de production : une garantie très partielle de souveraineté
En outre, il serait imprudent de considérer que les mesures visant à renforcer l'attractivité économique du territoire, aussi volontaristes (et coûteuses) soient-elles, puissent à elles seules garantir la souveraineté sanitaire de la France et de l'Europe au sens plein du terme, c'est-à-dire notamment la capacité à obtenir en priorité les produits nécessaires en cas de crise majeure.
En effet, dans une économie de marché, ce sont les clauses contractuelles qui priment et qui déterminent les pays qui seront livrés en priorité, en fonction du prix qu'ils ont payé. S'ils apportent des bénéfices en termes d'emplois et d'expertise, les investissements productifs réalisés par les entreprises sur un territoire donné obéissent seulement in fine à une logique d'optimisation des coûts (produire près de la demande à un coût acceptable), et ne signifient nullement un engagement de l'entreprise à livrer en priorité le pays de production, ni du reste le pays où l'entreprise a son siège, qui ne vaut pas « nationalité ».
En cas de crise majeure (sanitaire ou autre), il existe en réalité deux façons bien plus déterminantes, pour un État, de s'assurer une priorité en matière d'approvisionnement - et aucune ne peut s'improviser.
Premièrement, l'investissement direct : contrairement à l'acheteur ponctuel, l'actionnaire, ou au moins le financeur, a son mot à dire sur la stratégie de l'entreprise en matière de produits, de prix, d'implantation, etc. Cela plaide à nouveau pour que les pays européens s'inspirent du modèle de la BARDA américaine (cf. supra ). Or, au-delà du manque de capitaux publics mobilisables à l'échelle européenne, les États-membres sont souvent contraints dans leurs choix par les règles européennes en matière d'aides d'État qui, si elles prévoient des exceptions pour certains secteurs « stratégiques » (défense, sécurité, énergie, etc.), limitent les possibilités d'investir directement dans une entreprise. Les États-Unis ou la Chine, par contraste, ne sont pas soumis à de telles règles.
En France, des efforts importants ont certes été réalisés dans la période récente : l'industrie du médicament bénéficiera ainsi de 600 M€ au titre du plan de relance, dont elle constitue l'un des cinq « secteurs stratégiques », cette somme venant s'ajouter aux 11 Md€ prévus dans le cadre du programme d'investissements d'avenir (PIA). Le 16 juin dernier, Sanofi a annoncé l'investissement de 600 M€ en France, dont 200 M€ de financement public afin, d'après le Président de la République, de « financer des infrastructures de production comme de recherche et développement pour être en état de répondre aux besoins du temps et aux crises sanitaires », l'objectif de l'État étant de « développer un mécanisme de planification, de financement et d'organisation de la résilience industrielle française en matière de santé ». Toutefois, au-delà des mots, ces investissements publics demeurent des aides à la relocalisation « classiques », et ne sont pas en tant que tels réalisés dans un but de garantie stratégique de la production, qui supposerait des modalités bien plus spécifiques. Tout au plus est-il espéré que la souveraineté sanitaire découlera « naturellement » des aides à la relocalisation, un raisonnement dont la crise a montré la fragilité.
Parmi les exemples dont l'Europe gagnerait à s'inspirer, on peut citer la création en 2018 de Civica RX, un fabricant de génériques à but non lucratif par une alliance de quelque 900 hôpitaux américains, afin de faire face aux pénuries régulières de médicaments importés de Chine.
Deuxièmement, la contrainte légale : exception faite de l'obligation de constituer des stocks stratégiques, qui existe depuis longtemps et qui ne peut en tout état de cause pas répondre à une soudaine multiplication par 100 des besoins (comme ce fut le cas pour certains médicaments au printemps), il n'a pas été officiellement envisagé de prendre des mesures unilatérales contraignantes en matière de lieu de production ou de réquisition de la production.
Pourtant, lors de la première vague de la pandémie de Covid-19, il est apparu que la Chine avait été en mesure, pour ainsi dire, de se « réserver » en priorité une partie des masques et des médicaments fabriqués sur son territoire. Une telle action repose vraisemblablement des mécanismes, plus ou moins implicites, qui vont au-delà des seules règles de la liberté contractuelle et du commerce international.
D. BREVETS, ACCÈS AUX VACCINS ET COOPÉRATION INTERNATIONALE : UNE ÉQUATION ENCORE NON RÉSOLUE
1. Les brevets, moteur de l'innovation ou obstacle à l'accès aux vaccins ?
a. L'enjeu des brevets pour l'industrie pharmaceutique
L'un des principaux arguments avancés en faveur du droit de propriété intellectuelle est la nécessité d'encourager la prise de risque et l'innovation. Certains auteurs considèrent ainsi que sa reconnaissance est le moteur du développement économique rapide de l'Occident 64 ( * ) .
D'autres soulignent que la propriété intellectuelle peut aussi freiner de nouvelles innovations, par exemple en interdisant de réutiliser des innovations précédentes soumises à brevets 65 ( * ) , ou rendre plus difficile le développement des pays les plus pauvres, ne produisant pas de brevets, en limitant leur accès aux nouvelles technologies.
S'agissant d'un secteur tel que l'industrie pharmaceutique, nécessitant des investissements conséquents en recherche et développement ainsi que pour certifier les produits, alors que les coût de production de ces derniers sont relativement réduits, la protection offerte par les brevets permet au producteur de bénéficier pendant un temps d'un monopole sur son produit et de récupérer ainsi l'investissement effectué.
Ce monopole lui permet notamment de fixer de façon arbitraire les quantités de produit mis sur le marché et leur prix, avec pour conséquence potentielle d'exclure les plus pauvres, parfois un pays entier, de l'accès à celui-ci.
b. Les brevets remis en cause par de nouveaux entrants
L'Accord sur les aspects des droits de propriété intellectuelle qui touchent au commerce (ADPIC, en anglais Agreement on Trade-Related Aspects of Intellectual Property Rights : TRIPS), annexé à l'Accord instituant l'Organisation mondiale du commerce (OMC), est entré en vigueur en 1995. Compte tenu de l'enjeu, les grands laboratoires pharmaceutiques se sont montrés tout à fait favorables à son adoption.
Néanmoins, cet accord comporte plusieurs exceptions permettant, dans certaines situations, de lever, dans un pays donné, la protection offerte par les brevets, par exemple pour protéger la santé publique ou l'environnement. Ces possibilités ont été mises à profit à plusieurs occasions par des pays comme le Brésil, l'Inde ou l'Afrique du Sud, qui se sont dotés de l'infrastructure nécessaire pour produire leurs médicaments.
Ainsi, le 4 mai 2007, après des négociations infructueuses avec Merck, le Brésil a imposé une licence obligatoire pour le médicament antirétroviral Efavirenz dans le cadre d'une utilisation publique et non commerciale, ce qui a permis à ce pays de réaliser une économie de 237 millions de dollars sur cinq ans et de garantir la disponibilité de cet antiviral largement utilisé 66 ( * ) .
c. Vers des vaccins gratuits pour tous ?
Compte tenu des enjeux de la pandémie de Covid-19, notamment pour les pays en développement, certaines organisation non gouvernementales, comme OXFAM 67 ( * ) , considèrent qu'il convient de réunir les conditions d'une production massive de vaccins à très faible coût à l'échelle mondiale.
Elles ont récemment formé l'alliance The People's vaccine, avec de nombreux responsables politiques, des universitaires et des dirigeants d'organisations internationales, pour promouvoir cette proposition 68 ( * ) . A cette fin, elles appellent notamment les laboratoires pharmaceutiques travaillant sur les vaccins Covid-19 à partager leur technologie et leur propriété intellectuelle par l'intermédiaire de l'Organisation mondiale de la santé.
L'Inde et l'Afrique du Sud sont récemment allées plus loin, en demandant à l'Organisation mondiale du commerce de lever certaines dispositions des accords internationaux régissant les droits de propriété intellectuelle 69 ( * ) , afin d'accélérer la lutte contre la pandémie, considérant que certains pays en voie de développement, touchés de manière disproportionnée, auraient du mal à accéder rapidement aux vaccins ou aux médicaments nécessaires si celles-ci étaient maintenues. Cette proposition a notamment été soutenue par l'ONG Médecins sans frontière.
2. L'initiative internationale COVAX : une réponse partielle au problème de l'accès aux vaccins
a. Un objectif de distribution plus équitable des vaccins
Créée en septembre 2020, COVAX, aussi connu en anglais sous le nom COVID-19 Vaccines Global Access Facility , est une initiative internationale sous forme de partenariat public-privé visant à accélérer le développement, la fabrication et la distribution équitable de nouveaux vaccins contre la Covid-19.
Cette initiative est codirigée par Gavi - l'Alliance du Vaccin (en français, l'Alliance globale pour les vaccins et l'immunisation ou en anglais, Global Alliance for Vaccines and Immunization) , la fondation CEPI (Coalition pour les innovations en matière de préparation aux épidémies, ou en anglais Coalition for Epidemic Preparedness Innovations) et l'OMS.
COVAX apporte un soutien financier à la recherche et développement en matière de vaccins et négocie les prix avec les sociétés pharmaceutiques. L'objectif affiché de COVAX est de disposer à fin 2021 de 2 milliards de doses à distribuer permettant de vacciner environ 20 % de la population des pays participants, quel que soit leur niveau de revenu.
L'initiative comporte deux volets principaux : un pool d'achat pour les pays à revenu élevé, et l'AMC (Advance Market Commitment), un mécanisme de collecte de fonds pour les pays à faible revenu.
b. Des progrès encourageants
Au 3 décembre 2020, 186 pays avaient rejoint l'initiative COVAX 70 ( * ) , avec une répartition équilibrée entre 94 pays considérés comme à relativement haut revenu et 92 à bas revenu.
Par ailleurs, COVAX a réservé une capacité de production suffisante pour fabriquer plus d'un milliard de doses. Mais leur production nécessitera du temps. A court terme, 700 millions de doses seront effectivement disponibles.
Enfin, 2 milliards de dollars de financement ont été collectés par COVAX pour doter les pays à faible ou moyen revenu en vaccins. L'Union européenne a ainsi porté sa contribution à l'initiative COVAX à 500 millions d'euros le 22 novembre 2020 71 ( * ) . Globalement, l'apport total des pays de l'Union européenne s'élève à 870 millions d'euros, compte tenu du soutien directement apporté par certains pays, dont la France à hauteur de 100 millions d'euros.
c. Des objectifs restant à concrétiser
Malgré les progrès réalisés, l'initiative COVAX se heurte à plusieurs obstacles majeurs pour atteindre ses objectifs.
Le premier concerne la participation des grands pays, les États-Unis, la Fédération de Russie et la Chine n'ayant pas rejoint l'alliance avant la date limite d'adhésion fixée au 18 septembre 2020. Toutefois, la Chine est revenue sur sa décision au début du mois d'octobre, probablement pour essayer d'améliorer une image dégradée 72 ( * ) , puisqu'elle dispose de son propre vaccin. Par ailleurs, l'alternance politique pourrait également inverser la position américaine en début d'année.
Un deuxième obstacle, plus difficile à lever, résulte de l'absence d'engagement des pays membres de l'initiative à renoncer à s'approvisionner directement ou par un autre intermédiaire auprès des laboratoires pharmaceutiques. Imposer une exclusivité aurait évidemment opposé un obstacle majeur au recrutement des participants.
Il n'en reste pas moins que les contrats passés par un certain nombre de pays participants à l'initiative COVAX, ou de pays extérieurs à celle-ci, auront mécaniquement pour conséquence de réduire d'autant les capacités de production à destination des pays qui s'approvisionnent exclusivement par l'intermédiaire de celle-ci, soit par choix, soit par obligation, a fortiori si ces contrats prévoient une priorité d'approvisionnement.
Un troisième obstacle résulte simplement du montant insuffisant des contributions susceptibles de financer l'achat de vaccins pour les pays à revenus faibles ou moyen. Les besoins de financement ont d'ailleurs probablement été initialement sous-évalués par les promoteurs de l'initiative qui les estimaient à 2 milliards de dollars en 2020 et 5 milliards sur l'année 2021 73 ( * ) .
Or, le 9 décembre 2020, à l'occasion de la quatrième conférence annuelle entre l'Union africaine et l'ONU, le secrétaire général de cette dernière, António Guterres, a précisé qu'un apport à hauteur de 4,2 milliards de dollars dans les deux mois restait nécessaire à COVAX pour que la vaccination contre la Covid-19 puisse débuter avant le deuxième trimestre sur le continent africain. Il a également mis en parallèles les efforts considérables réalisés par certains pays pour assurer la vaccination de leur population et le manque de financement de l'initiative internationale 74 ( * ) .
En l'état actuel, les 700 millions de doses réservées de façon certaine par COVAX permettraient de vacciner environ 10% de la population totale, estimée à 3,6 milliards d'individus, des 92 pays participants les plus pauvres, sous réserve que d'autres pays n'aient pas besoin de leur propre quota. Or, après l'arrêt de son programme national de développement d'un vaccin 75 ( * ) , l'Australie a indiqué qu'elle ferait appel à COVAX pour s'approvisionner en vaccins tiers.
Une réponse partielle à ce déficit de vaccins pourrait venir des surplus dont disposeront les pays développés, en raison du nombre de candidats-vaccins susceptibles d'aller jusqu'au bout du processus de développement et d'autorisation. D'après, l'université Duke, en Caroline du Nord, quelques 5 milliards de doses de vaccins auraient d'ores et déjà été commandées par les pays développés 76 ( * ) . Néanmoins, cette redistribution pourrait conduire à de nouveaux défis logistiques ou à des inégalités parmi les pays les plus pauvres.
La France pourrait prendre l'initiative, directement ou via l'Union européenne, de proposer un système de redistribution équitable des doses excédentaires via l'initiative COVAX, si nécessaire en ajoutant un volet logistique correspondant.
IV. AXE 4 : COVID-19 : DÉFIANCE DE LA POPULATION, DÉFI DE LA VACCINATION
La stratégie de vaccination doit relever de nombreux défis, scientifiques, médicaux, logistiques ou économiques, évoqués précédemment. Or parmi ces défis, il en est un qui conditionne la réussite de tous les autres : la décision individuelle de se faire vacciner . En effet, dans la mesure où la contrainte d'une obligation vaccinale a été unanimement écartée, il s'agit de définir une stratégie permettant d'obtenir du plus grand nombre non seulement qu'il puisse, mais qu'il veuille, se faire vacciner. Dans ce contexte, un phénomène de défiance - d'une puissance inédite au sein de la population -constitue un facteur majeur de limitation des chances de réussite de la stratégie de vaccination. Seule une transparence aux implications multiples (connaissances et incertitudes scientifiques, communication claire des autorités publiques, gouvernance et chaînes de décision lisibles, prévention et lutte contre les conflits d'intérêt, éthique de responsabilité et d'intégrité chez les acteurs, démocratie sanitaire forte, pharmacovigilance rigoureuse...) peut permettre de renouer avec un niveau de confiance suffisant pour garantir l'efficacité de la campagne de vaccination.
A. UN DÉFICIT DE CONFIANCE RENFORÇANT L'HÉSITATION VACCINALE
1. La problématique classique des résistances à la vaccination
Comprendre les résistances contemporaines à la vaccination implique de les réinscrire dans leur histoire de longue durée. Comme l'expliquent l'immunologue Françoise Salvadori et l'historien Laurent-Henri Vignaud dans leur ouvrage Antivax 77 ( * ) , la méfiance ou l'hostilité à l'égard de la pratique vaccinale, contrairement à ce que prétend l'OMS, ne sont pas « nouvelles » et n'adoptent pas aujourd'hui « des arguments très différents de ceux du passé ». Ils identifient ainsi quatre facteurs traditionnels d'antivaccinisme et/ou de résistance aux vaccins plus ou moins forts selon les contextes historiques - visibles dès la variolisation au XVIII e siècle avant même l'invention des vaccins modernes par Jenner puis par Pasteur - et qui persistent encore de nos jours.
Ces facteurs peuvent notamment être d'ordre religieux (les vaccins seraient « un attentat contre la Providence »), naturaliste (forme sécularisée du précédent, avec un fatalisme de soumission à ce qui est imposé par la nature), « alterscientifique » (utilisation d'arguments « scientifiques » ou « pseudo-scientifiques » comme l'idée d'une bonne hygiène de vie) et, enfin, politique (méfiance à l'égard des politiques de santé et de l'État, allant jusqu'à la mise en cause de ses liens avec Big Pharma (ou complexe médico-scientifique), ces thèses pouvant prendre la forme de théories complotistes, comme celles de décisions politiques qui seraient prises lors des réunions secrètes du club Dolder). La variante conspirationniste du facteur politique de résistance à la vaccination existe et joue un rôle, mais la résistance aux vaccins est donc loin de lui être réductible 78 ( * ) . Les théories purement complotistes , qualifiées de « mal endémique » par le philosophe Alain Cambier 79 ( * ) restent en fait minoritaires dans les phénomènes d'hésitation vaccinale . Il est vrai qu'elles ont pu devenir très visibles sur les réseaux sociaux, à la faveur de « l'infodémie » caractérisant la crise sanitaire de la Covid-19 en 2020, avec la circulation d'informations trompeuses ou fausses. Elles concernent, par exemple, la crainte d'un complot mené par Big Pharma et Bill Gates afin de vendre des vaccins ou, pire, d'un plan supranational réunissant l'Organisation mondiale de la santé (OMS), la fondation Bill-et-Melinda-Gates et l'industrie pharmaceutique pour imposer un vaccin permettant de « pucer » l'humanité ou d'inoculer des nanoparticules dans le but de stériliser la population mondiale.
Si les médias donnent une large place au complotisme pour expliquer l'hésitation vaccinale, les experts et sociologues entendus par l'Office, ainsi que les sondages disponibles - notamment depuis le mois de novembre 2020 - ont démontré que les théories complotistes n'étaient une explication ni principale ni suffisante à la hausse des réticences. Ils ont exprimé leurs craintes d'une survalorisation de ces théories, puisque les pratiques de debunking , fact checking ou déconstruction des fausses informations participent à leur donner une existence et à les amplifier 80 ( * ) . Ces doutes radicaux ne gagneraient pas, selon les personnes entendues, à être rediscutés, sinon au risque de leur donner une plus grande publicité encore.
2. Le continuum de l'hésitation vaccinale : du refus de toute vaccination à la résistance par prudence
La note scientifique de l'Office sur la politique vaccinale en France 81 ( * ) et l'audition publique de l'Office sur « l'hésitation vaccinale » 82 ( * ) , ont permis d'entendre différents sociologues et historiens et d'actualiser la connaissance du phénomène d'hésitation vaccinale, afin de proposer une analyse plus nuancée du phénomène et des mécanismes qui distinguent l'antivaccinalisme radical de l'hésitation vaccinale, laquelle porte non pas sur un rejet total de la pratique de la vaccination, mais plutôt sur des craintes rationnelles exprimées à l'égard d'un vaccin spécifique dans un contexte particulier .
Les approches qui consistent à dichotomiser les populations sont erronées : le rapport des personnes aux vaccins, examiné sous l'angle sociologique et psychologique ainsi qu'à la lumière des sciences cognitives et des sciences de l'information, démontre une origine multifactorielle de la défiance à l'égard des vaccins, dont l'histoire est parallèle à celle de la vaccination.
En effet, réduire l'hésitation vaccinale à une fronde contre les vaccins de la part du « mouvement antivax » ou à une multiplication des thèses conspirationnistes comme cela est parfois rapporté dans les médias est erroné, puisque l'hésitation vaccinale, surtout actuellement, se distingue d'abord par sa complexité . De nombreux travaux font ainsi valoir son caractère multifactoriel : elle est d'origine personnelle lorsqu'elle relève des émotions, valeurs, perception des risques, connaissances ou croyances ; mais aussi sociale, culturelle, politique et historique 83 ( * ) . Elle s'exprime dans un continuum d'attitudes diverses aux fondements multiples et complexes , d'où ses nuances diverses, allant de la crainte au refus de la vaccination, en passant par l'inquiétude, la méfiance, ou, encore, la résistance.
Il est, en fait, difficile, voire impossible, d'appréhender au niveau strictement individuel le concept de balance bénéfices/risques, qui est à l'origine des politiques vaccinales. Ce bénéfice mêle l'utilité et l'efficacité des vaccins or la mesure de ce rapport, qui est un facteur décisionnel crucial pour les politiques publiques de santé, est très délicate à transposer si l'on se positionne en tant qu'individu. Les stratégies vaccinales sont décidées en fonction de données statistiques globales avec des mesures de probabilités sur des échelles collectives. Dès 1766, dans son Essai d'une nouvelle analyse de la mortalité causée par la petite vérole , Daniel Bernoulli a montré que le nombre de vies sauvées était globalement plus grand que celui de vies perdues, justifiant par-là la variolisation.
Contrairement à l'intuition qui conduit chacun à décider de se faire vacciner ou pas (intuition, le cas échéant, corrélée à des connaissances scientifiques et statistiques), l'efficacité des vaccins doit être appréhendée au niveau d'une société et pas au plan individuel, même s'il est préférable que les deux niveaux se rejoignent le plus souvent possible. Cette efficacité ressort de la comparaison entre un nombre de cas déclarés - soit l'incidence, soit la morbidité - et le nombre de décès - la mortalité - au sein de populations vaccinées et de populations non vaccinées.
L'efficacité d'un vaccin sur un plan individuel est toujours relative, jamais absolue. À l'échelle d'un individu, la probabilité de rencontrer le virus concerné peut être faible ou extrêmement faible, la probabilité que ce virus provoque une maladie grave peut être faible ou extrêmement faible et les risques peuvent eux-aussi être très variables et être parfois grands. Il existe ainsi des effets secondaires dont l'ampleur est très variable d'un vaccin à un autre et d'un individu à un autre, pouvant aller jusqu'à la survenue de pathologies auto-immunes, sans même parler de l'effet potentiel des adjuvants ou d'allergies mortelles.
Contrairement à une idée reçue, l'hésitation vaccinale ne témoigne pas systématiquement d'un manque d'éducation ou de savoir médical. L'une des explications mise en avant par les historiens des épidémies est aussi l'oubli historique , alors que des maladies infectieuses comme la poliomyélite reculent, voire disparaissent, la pertinence des vaccins devient moins évidente.
Les travaux de Coralie Chevallier 84 ( * ) ou encore de Jeremy Ward et de Patrick Peretti-Watel 85 ( * ) plaident pour la prise en compte de la sociologie cognitive dans l'approche de l'hésitation vaccinale puisque cette dernière s'explique aussi par des biais de la cognition ordinaire ou raccourcis mentaux. Ainsi, par exemple, en sociologie du risque, le biais d'omission fait craindre davantage les conséquences de la vaccination plutôt que son abstention, tandis que le biais de disponibilité concentre l'attention sur les risques vaccinaux (minimisation du risque sanitaire contre maximisation du risque vaccinal). L'effet « Dunning-Kruger » désigne le fait que des personnes peu informées sur un sujet et manquant de compétences se pensent plus renseignées que les experts eux-mêmes. Les différentes études mettent en évidence une mauvaise perception de la balance bénéfice/risque. Cette résistance s'éclaire aussi par des logiques individuelles : une frange de la population, les plus jeunes notamment 86 ( * ) , juge ne pas avoir à se faire vacciner car elle ne s'estime pas à risque ou ne craint pas la maladie.
Il existe, par ailleurs, un écart notable entre attitude face aux vaccins et comportement de vaccination . Les sondages concernant les intentions de vaccination, largement médiatisés et faisant craindre un échec des campagnes vaccinales, peuvent être contredits en pratique, car il est constaté que des personnes qui se déclarent rétives à la vaccination choisissent tout de même d'y recourir. Ce phénomène s'observe selon des proportions variables. Ainsi, la couverture vaccinale contre la grippe saisonnière, bien qu'en deçà de l'objectif de couverture de 75 % préconisé par l'OMS pour les groupes vulnérables, croît au fur et à mesure des années comme l'a rappelé Alain Fischer, témoignant d'une adhésion grandissante des publics ciblés pour un vaccin proche de celui contre la Covid-19.
Lors de son audition, le sociologue Jeremy Ward a mis l'accent sur le fait que l'acceptabilité des vaccins ne pouvait se faire sans une accessibilité accrue et a déploré que la question des difficultés rencontrées pour vacciner toute une population ne soit pas davantage abordée d'un point de vue logistique. En effet, plusieurs études ont mis en évidence qu'un des facteurs favorisant l'hésitation vaccinale et une moindre couverture vaccinale est la difficulté d'accès à l'acte de vaccination.
Il n'en reste pas moins que la question de « l'hésitation vaccinale » 87 ( * ) , a connu un certain regain depuis 2009, comme l'a montré l'épisode de la grippe H1N1 selon le sociologue Jocelyn Raude 88 ( * ) , du fait de la mise en évidence de liens d'intérêts entre les laboratoires pharmaceutiques et les experts, ou encore de manière pratique sous l'effet de la moindre couverture vaccinale réalisée à l'époque. L'Organisation mondiale de la santé (OMS) a déclaré en janvier 2019 que l'hésitation vaccinale faisait partie des dix grandes menaces sanitaires mondiales 89 ( * ) , aux côtés du changement climatique, de la dengue ou encore du VIH et la France est aujourd'hui la championne du monde du scepticisme vaccinal : un sondage réalisé par Santé Publique France a révélé que si 64 % des personnes interrogées en juillet 2020 étaient prêtes à se faire vacciner contre la Covid-19, ce taux était descendu à 54 % en octobre 2020 90 ( * ) (57 % en septembre 2020 91 ( * ) ), contre 83 % en Corée du Sud, 69 % en Allemagne ou encore 64 % en Espagne. Une enquête, réalisée par l'institut IFOP pour le Journal du Dimanche publiée le 28 novembre 2020 92 ( * ) , révélait même que ce seuil était abaissé sous la barre des 50 %, avec 41 % de personnes ayant l'intention de se faire vacciner lorsque cela deviendra possible (28 % dans les catégories populaires, 29 % chez les moins de 35 ans).
3. Des difficultés accrues en 2020 avec une nouvelle ère du soupçon liée à la crise de la Covid-19
Le but de la stratégie vaccinale étant l'immunisation d'une partie suffisamment importante de la population pour contrôler l'épidémie, de tels taux de rejet de la vaccination rendent toute campagne inefficace. Pour mémoire, le Conseil scientifique a ainsi fixé un seuil minimal de 65 %, certains experts allant même jusqu'à 80 % ou 90 %.
Au-delà même des théories purement complotistes visant la crise de la Covid-19 ou sa gestion, évoquées précédemment, l'hésitation vaccinale est en 2020 nourrie par des éléments spécifiques dans le contexte d'une nouvelle ère du soupçon, ainsi que le fait valoir le sociologue Pascal Lardellier. Cette ère du soupçon, précipitée par la crise de la Covid-19, avait été progressivement ouverte auparavant, conduisant à une défiance sans précédent à l'égard du gouvernement, des institutions et, dans une moindre mesure, des professionnels de santé.
Dans leur synthèse Pandémie 2020, éthique, société, politique , l'éthicien Emmanuel Hirsh 93 ( * ) et un collectif de 131 contributeurs soulignent qu'il y a eu un manque criant de respect des fondamentaux éthiques qui ont nourri la défiance , en particulier un manque de concertation et un déficit de communication tout au long de la crise sanitaire. De même, dans leur ouvrage Covid-19 : une crise organisationnelle 94 ( * ) , les sociologues Patrick Castel, Henri Bergeron, Olivier Borraz et François Dedieu ont énuméré de nombreux dysfonctionnements dans la gestion de la crise sanitaire : manque de recul sur l'impact psycho-social du confinement ; décisions prises sans anticipation ou préparation ; multiplication des cellules et comités, lesquels opacifient la prise de décision au lieu de simplifier la coordination ; manque de retour d'expérience... L'indépendance des acteurs de la stratégie vaccinale à l'égard des intérêts privés a aussi pu faire l'objet d'interrogations, comme cela a pu être vu lors des auditions conduites par l'Office. Ces interrogations font courir le risque de répercussions négatives sur l'acceptabilité du vaccin et la confiance des Français dans la stratégie mise en oeuvre. En effet, le Comité vaccins en charge de conseiller le Gouvernement, présidé par Marie-Paule Kieny, est par exemple composé pour partie d'anciens responsables de l'industrie pharmaceutique, présence que le comité juge « bénéfique », mais qui n'est pas sans faire planer un doute sur l'existence de conflits d'intérêts.
Dans l'éditorial du British Medical Journal du 13 novembre 2020 intitulé « Politisation, corruption et suppression de la science » et sous-titré « quand la bonne science est supprimée par le complexe médico-politique, les gens meurent » 95 ( * ) , il est affirmé que la crise de la Covid-19 aurait révélé une corruption de l'État, des scientifiques et des experts en santé à grande échelle. S'il est plausible selon cette revue que les gouvernements aient « supprimé la science » pour accélérer la disponibilité des diagnostics et des traitements, il n'en reste pas moins que les comportements sous-jacents sont « troublants » et induisent de la défiance : l'opacité des délibérations, le secret entourant les décisions et les politiques d'achat des tests de diagnostic, des médicament et des vaccins, ou encore l'impression que la politique scientifique serait définie sur la base des communiqués de presse de l'industrie pharmaceutique...
Tout au long de la crise sanitaire liée à la Covid-19, les stratégies de communication et de diffusion de l'information ont, de plus, pu apparaître de plus en plus confuses : la succession des études scientifiques contradictoires, la diffusion de fake news , les propos contradictoires et les hésitations politiques quant aux mesures à mettre en place se sont conjugués et renforcés les uns les autres. L'épisode de l'étude frauduleuse sur les effets de l'hydroxychloroquine, publiée par la revue scientifique The Lancet en mai 2020, suivie de décisions de plusieurs gouvernements défavorables à ce médicament a lui aussi accrédité la thèse selon laquelle la communication sur les réponses à apporter à la Covid-19 était l'objet de graves manipulations. Notre collègue sénateur Alain Houpert, médecin et ancien membre de l'Office, a même dénoncé une politique sanitaire où la « raison a été mise à l'isolement ».
En France, un sondage publié par Odoxa en avril 2020 96 ( * ) révélait que près de 76 % des sondés considèrent que le gouvernement leur avait « caché la vérité » au sujet des masques et qu'il avait manqué de cohérence ou de clarté. Un autre sondage, daté de novembre 2020 97 ( * ) , évaluait à 42 % seulement le pourcentage, chiffre pourtant en augmentation, de sondés accordant leur confiance au gouvernement pour faire face à l'épidémie en cours. Cette défiance à l'égard de la gestion gouvernementale de la crise se concentre tout particulièrement autour des messages et recommandations parfois contradictoires au sujet du port du masque, du confinement, de l'opacité des décisions 98 ( * ) ou des liens supposés du gouvernement avec les industries pharmaceutiques. De même, l'étude Ipsos « Fractures françaises » 99 ( * ) , précitée et publiée en octobre 2020, révèle, que pour 78 % des personnes interrogées les représentants politiques agissent pour leurs intérêts personnels.
Or la perte de confiance dans les institutions publiques est, selon le sociologue Jocelyn Raude et une équipe de chercheurs dont fait partie Jeremy Ward 100 ( * ) , une raison majeure qui éclaire la hausse récente de la réticence vaccinale de la France, plus grande dans notre pays que dans les autres pays européens : « la vaccination devient un marqueur identitaire : pour ou contre le gouvernement » 101 ( * ) . L'historien Laurent-Henri Vignaud ajoute que « les Français, quand on leur pose la question de la sûreté des vaccins, ils répondent à une autre question, qui est celle de la confiance qu'ils portent d'une part dans le gouvernement et d'autre part dans l'industrie pharmaceutique et le système de production industrielle des vaccins » 102 ( * ) . À ce titre, l'hésitation vaccinale s'avère particulièrement forte aux extrêmes du spectre politique, chez les sympathisants du Rassemblement national (RN), de La France insoumise (LFI) et chez les personnes éloignées du système politique 103 ( * ) , comme l'ont déjà étudié plusieurs travaux faisant le lien entre montée des populismes et hésitation vaccinale 104 ( * ) .
De plus, la confiance dans les vaccins dépend à la fois de la confiance placée dans le gouvernement, ainsi que de celle placée dans les professionnels de santé, le système de santé ou la parole scientifique . À cet égard, Pierre Verger et Patrick Peretti-Watel ont proposé une définition de l'hésitation vaccinale basée sur la confiance. Ils évoquent un « processus de décision influencé par la confiance que les personnes placent dans les autorités de santé et la médecine classique et leur degré d'engagement dans le “santéisme” (propension à contrôler ses comportements de santé pour augmenter son espérance de vie, en utilisant les informations officielles sur la santé) » 105 ( * ) . Un baromètre publié par Ipsos en décembre 2020 106 ( * ) estime que seul 57% des Français font confiance aux scientifiques pour dire la vérité sur les vaccins, qu'ils soupçonnent notamment d'avoir des liens d'intérêts avec l'industrie pharmaceutique, sentiment amplifié par les désaccords, particulièrement médiatisés, entre les scientifiques, mais il est rassurant de voir que la confiance dans la science, rassemblant 90% des sondés, reste très élevée selon un baromètre de la Fondation Nicolas Hulot 107 ( * ) .
À cet égard, la question de la mauvaise gestion de la crise sanitaire par le gouvernement est revenue à plusieurs reprises lors des auditions de l'Office tant pour éclairer le regain de l'hésitation vaccinale que pour orienter l'équilibre qui doit être trouvé dans l'élaboration et la conduite de la stratégie vaccinale.
B. LA STRATÉGIE DE VACCINATION EST SOUMISE À UN IMPÉRATIF DE TRANSPARENCE
1. Restaurer la confiance par la transparence
L'historien de la santé Laurent-Henri Vignaud, éclairant la méfiance à l'égard de la parole publique, suggère ainsi que les critiques formulées contre la gestion gouvernementale de la crise sanitaire doivent aiguiller la communication de la stratégie vaccinale, laquelle doit être claire, accessible et précise . Il s'agit de tenir un « discours de confiance », qui consiste à dire « quand on sait, et quand on ne sait pas », une position affirmée par Alain Fischer lors de son audition. Ces remarques rejoignent le Conseil consultatif national d'éthique (CCNE) qui plaidait ainsi de manière générale « pour une communication transparente et responsable s'appuyant davantage sur le corps social » face à la Covid-19 108 ( * ) . Récemment, le CCNE a, dans son avis n°135 sur « l'accès aux innovations thérapeutiques et aux enjeux éthiques », publié le 30 novembre 2020, a posé l'impératif de transparence comme première recommandation.
La stratégie de vaccination est donc soumise à un impératif de transparence pour espérer restaurer la confiance. Les implications d'une telle transparence sont multiples : elle concerne d'abord l'état des connaissances et les incertitudes scientifiques, mais elle appelle également une communication claire de la part des autorités publiques, une gouvernance et des chaînes de décision lisibles, le principe de responsabilité des acteurs, la prévention et la lutte contre les conflits d'intérêt ou, encore, le respect de l'intégrité et des principes éthiques.
La communication doit donc tant porter sur les vaccins, leurs effets secondaires, la nouveauté technologique des vaccins à ARN que sur la campagne de vaccination elle-même.
Force est de constater que le grand public manque encore ainsi d'information sur les vaccins en général et plus particulièrement sur celui contre la Covid-19. Un phénomène de résistance vaccinale qui s'apparente davantage à de la prudence dans un contexte d'incertitudes sur l'état des connaissances est palpable dans l'expression d'un délai dans le souhait de se faire vacciner. Un sondage Ipsos109 ( * ) a ainsi mis en évidence parmi les personnes désireuses de se faire vacciner l'expression d'un souhait de pouvoir bénéficier d'un délai pour avoir du recul : 12% des Français se feraient vacciner immédiatement ; 13% moins d'un mois après ; 13% entre un et trois mois.
Une partie de la résistance vient, il est vrai, du manque de recul sur les vaccins, nombreux, qui sont actuellement annoncés. À la désinformation s'associe donc le manque d'information, qui empêche le citoyen d'aboutir à un « choix éclairé ». Les sondages, comme celui de l'OMS 110 ( * ) publié en août 2020, font valoir que la raison principale au refus de la vaccination porte sur la crainte d'effets indésirables, puis sur la mise en doute de l'efficacité du vaccin. Ces critères ne sont pas hermétiques : il est tout à fait possible d'être convaincu de l'efficacité d'un futur vaccin contre la Covid-19, tout en craignant ses possibles effets secondaires. Ces sondages confirment que l'hésitation vaccinale ne veut pas dire rejet de la vaccination dans son ensemble. La méfiance envers les vaccins en cours de développement provient en grande partie du sentiment que le vaccin a été développé de manière hâtive, mais aussi avec une certaine désinformation de la part des médias.
La question de la sécurité des vaccins s'est posée depuis quelques années à la faveur de plusieurs controverses touchant aux vaccins (adjuvants aluminiques, vaccin contre l'hépatite B ou le HPV, vaccins multivalents, obligation vaccinale des enfants). La question de la technologie à ARN messager, peu explicitée, crée également des difficultés particulières. À cet égard, Jeremy Ward a rappelé lors de son audition qu'à l'heure où seuls des communiqués de presse sont disponibles, se précipiter sur le sujet de l'acceptabilité du vaccin pouvait être en partie prématuré alors même que les données et les dépôts d'AMM ne sont pas toujours disponibles.
Pour autant, la communication sur la stratégie vaccinale doit intervenir le plus tôt possible : plusieurs travaux, dont ceux du groupe Coronavirus et Confinement (Coconel) et ceux de Jeremy Ward montrent qu'une des erreurs est de ne pas communiquer assez, assez tôt et de manière correcte 111 ( * ) , comme l'illustre l'exemple de la grippe H1N1.
L'hésitation vaccinale face au Covid-19 se différencie aussi par les acteurs et les publics visés. L'un des arguments principaux de résistance à la vaccination pédiatrique chez les parents hésitants est de protéger leurs enfants contre d'éventuels effets secondaires, mettant ainsi au jour des arguments touchant aux liens d'affection et familiaux. Le vaccin contre la Covid-19 vise cette fois des adultes, encouragés à se protéger eux-mêmes et par extension leurs concitoyens. L'étude rapprochée de ces liens d'affection en plus des déterminants contextuels, individuels et de groupes, pourrait permettre de vaincre la résistance qui se manifestera de la part des descendants donnant leur consentement pour la vaccination des seniors.
La complexité du phénomène d'hésitation vaccinale permet d'envisager la mobilisation de différents acteurs : les médecins (utilisation des sciences cognitives pour améliorer l'adhésion vaccinale), les autorités de santé (transparence et communication), mais aussi les médias et réseaux sociaux 112 ( * ) ... Il faudra donc communiquer dans un contexte nouveau mais les réseaux sociaux peuvent être vus comme des alliés plutôt que des ennemis.
Dans ce contexte, la communication des professionnels de santé est essentielle. La crise sanitaire a permis de mettre au jour une forme de défiance envers les scientifiques, favorisée par le brouillage de la parole scientifique induit par la multiplication de prises de parole contradictoires, la dispersion des lieux de prises d'information ou encore le trop plein d'informations induit par le format des chaînes d'information en continue et les réseaux sociaux. Les travaux de Pierre Verger et d'Ève Dubé insistent sur la nécessité de restaurer la parole médicale pour lutter contre le phénomène d'hésitation vaccinale 113 ( * ) . Accroître la confiance dans les professionnels de santé, passe d'une part par la restauration de la crédibilité accordées à leur parole et d'autre part par la lutte contre l'hésitation vaccinale chez les professionnels de santé eux-mêmes, qui doivent être mieux formés et informés . Certains d'entre eux, en effet, ont pu exprimer des doutes sur l'efficacité ou l'innocuité du vaccin, cette réticence étant notamment motivée par le manque d'informations entourant les vaccins contre la Covid-19. La stratégie vaccinale pourrait tirer des enseignements de la vaccination contre la grippe H1N1 : les médecins de ville et professionnels de santé, mis de côté pendant la campagne comme le rappelle Élisabeth Bouvet 114 ( * ) , présidente de la commission technique des vaccinations de la Haute Autorité de Santé (HAS), doivent être au coeur de la stratégie en préparation pour ne pas fragiliser davantage leur rapport avec les autorités sanitaires, déjà ébranlée depuis plusieurs années comme le souligne Pierre Verger 115 ( * ) , et, ce faisant, la confiance des patients dans la stratégie vaccinale.
Les représentants des professionnels de santé entendus en audition ont rappelé le rôle-clef des professionnels de santé, piliers de la transparence et de l'information alors que le taux de confiance dans le médecin traitant atteint les 88%, et 94% pour les personnes frappées d'affections de longue durée, qui sont précisément les personnes qui seront prioritaires pour recevoir le vaccin contre la covid-19. Il faut donc s'appuyer sur les professionnels de santé , qui sont des acteurs privilégiés pour améliorer l'adhésion vaccinale de manière significative dans la population.
Les professionnels de santé, selon Alain Fischer, doivent être des « vecteurs d'explication [...] d'une information de qualité » car c'est en eux qu'ont, en premier lieu, confiance les Français. Le rôle de la société civile, parmi laquelle les associations de patients, est aussi essentiel, « ambassadeurs de la vaccination au travers de leur propre expérience ». Emmanuel Rush, président de la Conférence nationale de santé (CNS), a soutenu, lors de son audition, l'idée d'inscrire le discours qui sera tenu pendant la stratégie vaccinale dans le récit d'une mobilisation contre une « catastrophe naturelle, qui percute la planète et notre pays » plutôt que d'employer un lexique guerrier contre-productif, et ce, afin de donner du sens à l'événement vécu par les Français et de les faire s'unir.
Dans son avis du 9 juillet 2020 sur la stratégie de vaccination 116 ( * ) , le Comité scientifique COVID-19, le Comité Vaccin COVID-19 et le Comité Analyse Recherche Expertise (CARE) COVID-19 ont affirmé que la communication est une condition de réussite d'une campagne vaccinale. Elle doit être transparente sur les procédures ayant permis l'accélération de la mise sur le marché sans apparaitre comme ayant été menée au détriment de la sécurité, sur les incertitudes et les fondements scientifiques des recommandations. La communication devra ainsi explicitement préciser que l'accélération de la vitesse de développement des nouveaux vaccins ne concerne pas les étapes de sécurité, qui seront maintenues, mais les modes de développement et de production. Elle doit montrer, à partir de données vérifiables et quantifiées, éventuellement par des chiffres, l'intérêt de la vaccination en général pour que celle-ci reprenne sa place dans les schémas de prévention de santé. Les circuits de vaccination (prescription, mise à disposition, injection...) doivent être simples. La communication doit être réalisée dès l'amont de la campagne, être différenciée selon les publics cibles et privilégier des valeurs positives. Une communication spécifique ciblant les « vaccinateurs » potentiels sera importante. Il sera également nécessaire de mettre l'accent sur l'aspect altruiste de la vaccination et évoquer une forme de « contrat social » en appelant à la responsabilité de chacun.
En outre, le calendrier de vaccination doit être réaliste et éviter la précipitation , car cette dernière, outre les questions de difficultés logistiques et de dispensation, fait courir un risque sous-jacent de défiance. Ainsi, la date du 4 janvier 2021 pour démarrer la première phase de vaccination ne doit pas être fétichisée. Ce calendrier devrait être plutôt indicatif et ajustable en fonction de l'évolution des circonstances.
2. Valoriser l'éthique de responsabilité et l'éthique en santé publique
Pour la prévention des conflits d'intérêt, le site gouvernemental https://www.transparence.sante.gouv.fr rend accessible l'ensemble des informations déclarées par les entreprises sur les liens d'intérêts qu'elles entretiennent avec les acteurs du secteur de la santé. Pilotée par le ministère des solidarités et de la santé, cette base de données publique vise à améliorer la relation de confiance entre les citoyens, les usagers et les multiples acteurs du système de santé. Cette initiative de transparence va dans le bon sens et doit être poursuivie et amplifiée. Il serait ainsi pertinent de rendre obligatoire la déclaration d'intérêts de l'ensemble des personnes qui interviennent dans le champ de la stratégie vaccinale.
L'éthique de responsabilité et l'éthique en santé publique ont toute leur place dans l'élaboration et la mise en oeuvre de la stratégie vaccinale. La question de l'imputabilité doit aussi y tenir une place importante.
La stratégie vaccinale doit s'efforcer de rétablir une juste perception de la balance bénéfice/risque - centrale dans le processus de décision - et de restaurer les cultures de la prévention et du risque 117 ( * ) . Les syndicats de médecins auditionnés ont rappelé qu'il revient au médecin de convaincre que le bénéfice est supérieur au risque, ce qui peut se faire en soulignant combien, chez les populations à risques, il y a plus de chances de mourir de la Covid-19 que de l'administration du vaccin.
La mise en place du confinement pendant la crise sanitaire a témoigné de la nécessité de réduire les droits individuels et collectifs, ainsi que la liberté civile, dans le but de protéger la collectivité. Cette situation de santé publique sans précédent implique de nombreux dilemmes éthiques. À cet égard, les principes de l'éthique en santé publique 118 ( * ) (mesurer le préjudice, limiter la coercition, garantir la réciprocité, favoriser la transparence), moins développés en France que ceux de l'éthique clinique (« autonomie » et consentement de la personne, « bienfaisance », « non-malfaisance » et balance bénéfice/risque, principe de « justice »), peuvent nourrir la stratégie vaccinale et la gouvernance quand ces dernières sont éclairées par des perspectives morales (conséquentialisme, utilitarisme, déontologie, libéralisme, communautarisme, égalitarisme). L'éthique fait office de « boussole morale » entre des intérêts concurrents, tant pour les décisionnaires que les professionnels, les patients et le public. Un certain nombre d'études internationales en éthique en santé publique 119 ( * ) s'accordent sur l'importance de la clarté du cadre éthique, de la justice sociale (équité et égalité) et d'une communication claire, loyale et transparente dans la prise en charge d'une pandémie de grippe.
Bien que la capacité « stérilisante » du vaccin ne soit pas encore avérée - c'est-à-dire qu'il empêcherait la transmission de la maladie - la vaccination est présentée comme un enjeu de citoyenneté , un principe de solidarité utile à la collectivité et pouvant primer sur l'autonomie et les libertés individuelles. Dans un avis daté de mars 2020 120 ( * ) , le CCNE en appelle, à ce titre, à la « responsabilité citoyenne » : « Les concepts de liberté individuelle et d'intérêt général, de même que leur conflit potentiel, constituent l'un des enjeux éthiques d'un plan de lutte contre le développement d'une pandémie ». Il rappelle que celle-ci est obtenue par un arbitrage entre la sécurité obtenue en échange d'une restriction de liberté, adhésion qui se fait plus forte quand la confiance dans le gouvernement est haute. La confiance dans la vaccination passe par un « contrat social appelant à la responsabilité de chacun » 121 ( * ) . L'Académie nationale de pharmacie, aussi, souligne que c'est toujours le principe d'« autonomie relationnelle » qui préside à l'adhésion vaccinale, au sens où la solidarité permet au plus grand nombre d'exercer son autonomie : « La vaccination engage toute la population de manière préventive et solidaire. Le bien dont il s'agit ici se rapproche fortement du respect mutuel dû à chacun, autrement dit du principe d'autonomie. C'est bien à l'autonomie de l'autre que je porte atteinte par le refus de la vaccination, vu que l'autonomie en société est relationnelle, c'est-à-dire un principe qui renforce la solidarité » 122 ( * ) .
Coralie Chevallier, chercheure en sciences cognitives, propose donc la « motivation à être altruiste » 123 ( * ) comme un levier à la vaccination et propose de permettre aux personnes s'étant faites vacciner d'être identifiées comme des relais ou « ambassadeurs », par différents signes distinctifs (badge, autocollant, ruban, etc.) puisque plusieurs études dans des milieux hospitaliers ont mis en évidence le rôle positif de cette visibilisation de l'acte vaccinal.
Quelques autres questions éthiques
Responsabilité des médecins et des laboratoires en cas d'effets secondaires
L'éthique de responsabilité, souvent objet de débats dans la stratégie vaccinale, a pu soulever plusieurs questions, parmi lesquelles le fait de savoir si les laboratoires ayant mis les vaccins sur le marché et les professionnels de santé réalisant l'injection peuvent être tenus responsables en cas de survenue d'effets secondaires. La responsabilité des laboratoires en cas de la survenue d'effets secondaires a fait l'objet de polémiques puisque comparée à une « bulle d'immunité » : les États-membres et la Commission européenne se seraient en effet engagés sur une indemnisation pouvant être prise en charge par les pouvoirs publics, selon des modalités fixées par des contrats confidentiels. La responsabilité pénale et contractuelle incombera toutefois toujours au laboratoire en cas de vaccin « défectueux », mais sera levée si le laboratoire prouve qu'il ne pouvait en avoir connaissance. Dans le cas où le vaccin ne serait pas rendu obligatoire, la responsabilité du professionnel de santé pourrait être engagée en cas de faute (faute d'ordre technique ou de maladresse).
Recueillir des consentements libres et éclairés
Les acteurs auditionnés, tout comme la ministre déléguée à l'Autonomie Brigitte Bourguignon, ont rappelé l'absolue nécessité de disposer du « consentement libre et éclairé » (sans contrainte et informé), des personnes visées par la vaccination, prérequis sur lequel repose l'autonomie de la personne. Alain Fischer a renchéri : « il est hors de question de ne pas recueillir le consentement avant la vaccination. Soit quand c'est possible, la personne elle-même, et si la personne n'est pas en état de le donner, de ses proches ». Or qui sera chargé de fournir le consentement dans le cas de personnes seniors atteintes de troubles cognitifs, comme la maladie d'Alzheimer ou la démence alors que 40% à 60% des résidents en EHPAD privés seraient incapables de prendre des décisions les concernant 124 ( * ) ? Et quelle sera la forme prise par ce consentement (consentement écrit et versé au dossier médical, afin d'éviter toute contestation future) sur laquelle le Conseil consultatif national d'éthique (CCNE) doit publier un avis, dans la deuxième moitié de décembre 2020 ?
Le problème de la vaccination des volontaires ayant reçu un placebo
Que faire des dizaines de milliers de volontaires à qui a été injecté un placebo dans les phases de test du vaccin ? Pfizer a déclaré en octobre 2019 qu'il faut les informer de la possibilité d'un vaccin. D'autres préconisent même, comme Francis Collins, directeur de NIH, qu'ils aient un accès prioritaire au vaccin pour récompenser leur prise de risque.
L'éthique appliquée à l'allocation des ressources et à la lutte contre l'inégalité d'accès aux vaccins
L'insuffisance initiale en doses de vaccins ne va pas seulement créer une vaccination par vagues, visant des publics prioritaires. Elle risque aussi de créer une discrimination significative entre pays industrialisés et pays en voie de développement et pose ainsi la question de la solidarité des pays riches envers les plus pauvres . L'OMS a rappelé à ce titre que les valeurs éthiques telles que la justice et l'équité doivent présider à l'allocation des vaccins 125 ( * ) . L'enjeu éthique se double d'un enjeu stratégique. Une étude sur le partage équitable du vaccin, réalisée par des chercheurs l'université NorthEastern 126 ( * ) de Boston a estimé que la mortalité mondiale connaîtrait une baisse de 61% si le vaccin est partagé par tous, mais seulement une baisse de 33% si 50 pays riches monopolisent le stock.
Responsabilités des médecines alternatives
Lors de son audition, Françoise Salvadori a rappelé, en citant les travaux de Lucie Guimier 127 ( * ) , la nécessité d'exercer une veille et un contrôle sur les groupes sectaires, discours alterscientifiques et autres pratiques alternatives non reconnues par le champ médical.
3. Réaffirmer la démocratie sanitaire et renforcer la pharmacovigilance
Formulée par les agences régionales de santé (ARS) pour regrouper de manière concertée les acteurs du système de santé pour la mise en place et dans l'esprit de dialogue - des politiques de santé, la démocratie sanitaire vise la participation citoyenne aux politiques de santé. Dans la période récente la démocratie sanitaire cède de plus en plus le pas à un concept nouveau, plus large, la démocratie en santé.
Selon Didier Tabuteau, conseiller d'État et responsable de la chaire santé de Sciences Po, cette dernière se définit par le fait de tendre vers une organisation de la société reconnaissant la capacité de chacun à connaître, décider et agir pour sa santé et la politique de santé. Lors de son audition par l'Office, Emmanuel Rusch, professeur des universités-praticien hospitalier, président de la Société française de santé publique (SFSP), de la Conférence nationale de santé (CNS) et du Comité de Contrôle et de Liaison Covid-19, a évoqué l'avis de la CNS du 15 avril 2020 « La démocratie en santé à l'épreuve de la crise sanitaire du Covid-19 » 128 ( * ) . Cet avis se voulait une alerte face à la suspension de la démocratie sanitaire et au cadre légal mis en place qui porte atteinte aux droits fondamentaux : « la crise se prolongeant, la profusion des informations qui envahissent les sphères médiatiques, les communications parfois contradictoires sur les mesures à visée sanitaire prises, le décalage entre les annonces faites et la réalité perçue sur le terrain, alimentent une défiance grandissante vis-à-vis des pouvoirs publics et des critiques croissantes des décisions prises et des stratégies menées. Si certaines atteintes aux droits fondamentaux peuvent, pour un temps limité, être justifiées au regard de l'urgence sanitaire, il convient d'éviter tout recul et rupture injustifiés des droits des usagers du système de santé ou des personnes accueillies et accompagnées dans le médico-social, et des salariés en milieu professionnel, y compris en temps de crise ». La Conférence a regretté qu'aucune concertation ou association quelconque des structures concernées par le gouvernement n'ait eu lieu et a dressé le constat de « l'absence de mobilisation de la démocratie en santé, de ses représentants ou de ses instances, par les pouvoirs publics et les établissements de santé, médico-sociaux ou sociaux » et a « appelé les pouvoirs publics à faire, enfin, le pari de la démocratie en santé ».
La CNS, tout comme le CESE et la CNCDH, ont plaidé pour la mise en place d'une plateforme participative et non pour une structure de personnes tirées au sort pour concertation citoyenne. On s'oriente cependant vers la mise en place d'un « collectif citoyen » destiné à se porter garant d'une « totale transparence du suivi de la vaccination ». Il serait regrettable qu'une telle structure conduise à contourner les acteurs existants en mettant en scène un rapport direct avec des citoyens. Il faut rappeler que le Ségur de la santé qui s'est déroulé du 25 mai au 10 juillet 2020 visait dans sa 32 e mesure à renforcer la démocratie sanitaire.
Dans une interview, un médecin généraliste s'est inscrit en faux contre ce « collectif citoyen » pour d'autres motifs : « Cela fait partie de notre mission : nos patients nous interrogent tous les jours sur ces vaccins, pour savoir ce qu'on en pense, si on les recommande, si on va se faire vacciner. La consultation citoyenne, elle a lieu tous les jours dans nos cabinets ! » 129 ( * ) .
Le Conseil pour l'engagement des usagers de la HAS a, dans son avis n° 3/2020 du 9 novembre 2020, formulé sept recommandations très pertinentes 130 ( * ) , déclinant ainsi en actions concrètes la première des recommandations du présent chapitre de la présente note en faveur d'une démarche ambitieuse et concrète de transparence dans la définition et la mise en oeuvre de la stratégie de vaccination.
Il est regrettable que le concept de « dictature sanitaire » soit devenu si fréquemment évoqué alors que, dans le même temps, au sein de nos institutions, la démocratie sanitaire apparaît mise entre parenthèses : c'est pourquoi contre la notion de « dictature sanitaire » dénoncée sur les réseaux sociaux, il convient de renouer avec la démocratie sanitaire énoncée dans les textes législatifs.
Le rôle du Parlement, des corps intermédiaires et des institutions de la démocratie sanitaire est donc à réaffirmer dans le contexte actuel, pour contrôler l'action du gouvernement et le conseiller : ils ne sauraient pour autant être instrumentalisés en tant que cautions afin de servir à légitimer des décisions opaques. La transparence n'est pas un acte de foi et doit être mise en oeuvre concrètement en dépassant le stade des incantations.
Un dernier axe permettant de renouer avec la confiance consiste à renforcer la pharmacovigilance, disposition pour laquelle a plaidé, en 2016, une communication de membres de l'Académie nationale de médecine 131 ( * ) . L'ouverture du site https://signalement.social-sante.gouv.fr et celle du site https://vaccination-info-service.fr par Santé publique France vont ainsi dans le bon sens, mais ces sites doivent pouvoir se tourner vers tous les publics.
Pour mémoire, la pharmacovigilance est, dans le cadre des vaccins, pilotée au niveau national par l'Agence nationale de sécurité du médicament et des produits de santé (ANSM), qui s'intègre dans le système européen de surveillance et d'évaluation des médicaments. Tout signalement est transmis au centre régional de pharmacovigilance (CRPV) territorialement compétent. Sur la base de l'évaluation des signalements reçus et des autres données disponibles, l'ANSM peut être amenée à prendre des mesures préventives ou correctives : information sur le bon usage des médicaments, renforcement des conditions de prescription et de délivrance, retrait du marché, etc. Les données issues du signalement sont anonymisées avant enregistrement dans la base nationale de pharmacovigilance.
Ces outils et ces procédures existent, il reste à s'en saisir pleinement. Une synthèse des résultats des enquêtes de pharmacovigilance devrait figurer sur un portail unique dédié à la vaccination fournissant une synthèse de l'ensemble des informations disponibles.
Recommandation Adopter une démarche ambitieuse et concrète de transparence dans la définition et la mise en oeuvre de la stratégie de vaccination, tant au niveau de l'action que de la communication, afin de rétablir la confiance nécessaire en s'appuyant sur un canal d'information simple, clair et accessible tel qu'un portail unique fournissant une synthèse de l'ensemble des informations disponibles (par exemple le site https://vaccination-info-service.fr ), dont celles relatives aux vaccins et à leurs effets, aux modalités de la stratégie vaccinale et à sa gouvernance.
Recommandation Prévenir et lutter contre les conflits d'intérêt, en rendant obligatoire la déclaration d'intérêts de l'ensemble des personnes qui interviennent dans le champ de la stratégie vaccinale et en amplifiant la visibilité des initiatives du type du site https://www.transparence.sante.gouv.fr .
Recommandation Utiliser les acquis des sciences humaines et sociales pour mieux mettre en oeuvre la stratégie de vaccination, notamment la sociologie politique et la sociologie cognitive. Le rôle des personnes vaccinées a ainsi été identifié comme un facteur facilitant et des collectifs d'ambassadeurs du vaccin devraient être mis en place avec des personnalités publiques et des citoyens volontaires.
Recommandation S'appuyer sur les professionnels de santé, acteurs privilégiés pour améliorer l'adhésion vaccinale de manière significative dans la population.
Recommandation Renforcer la pharmacovigilance et ses dispositifs en les faisant mieux connaître à l'image du site https://signalement.social-sante.gouv.fr dont une synthèse des résultats devrait figurer sur le portail unique dédié à la vaccination.
Recommandation Réaffirmer le rôle du Parlement, des élus locaux dont les maires, des corps intermédiaires et, en particulier, des institutions de la démocratie sanitaire dans la stratégie vaccinale, en veillant à ce que le recours à des comités de citoyens tirés au sort leur soit complémentaire, ne les contourne pas ni ne s'y substitue.
Recommandation Adopter un calendrier de vaccination réaliste évitant la précipitation et le risque sous-jacent de défiance ; la date du 4 janvier 2021 pour démarrer la première phase de vaccination ne doit pas être fétichisée.
RECOMMANDATIONS
1. Axe 1 - Connaissances et incertitudes scientifiques
• Il est pertinent, au plan sanitaire, de proposer la vaccination aux personnes ayant déjà contracté la COVID-19. Cependant, dans un contexte de limitation des doses de vaccin, les personnes disposant d'un résultat de RT-PCR positif pourraient être écartées des deux premières phases de vaccination définies par la Haute autorité de santé, même si cela pourrait causer des difficultés logistiques.
• Le virus et son épidémiologie doivent être surveillés pour pouvoir rapidement identifier toute mutation signifiante. Les efforts de séquençage du génome doivent continuer, tout particulièrement si des cas d'échappement vaccinal surviennent.
• Le risque d'effets secondaires bénins, plus fréquents qu'habituellement, doit absolument être expliqué aux personnes recevant le vaccin, au risque qu'une partie d'entre elles ne reçoive pas la seconde injection.
• La balance bénéfices-risques est largement en faveur de la vaccination par un vaccin tel que celui proposé par l'alliance Pfizer/BioNTech pour la population âgée. Les scientifiques pointent l'absence de recul sur d'éventuels effets indésirables à long terme en population générale, de type manifestations auto-immunes, que la population âgée est peu susceptible de développer.
2. Axe 2 - Une stratégie de vaccination progressive, dont la réussite repose sur une bonne maitrise de la chaine vaccinale
• Clarifier les rôles et fonctions de chacun des intervenants, disposer d'une vision précise du périmètre dévolu à chaque organisme, y compris dans la communication sur la stratégie de vaccination, afin d'éviter toute impression de cacophonie.
• Préserver le rôle du Parlement dans son rôle d'évaluation des politiques publiques et de contrôle de l'action du Gouvernement, qui prend les décisions et a la responsabilité finale de l'ensemble du dispositif de vaccination.
• Réaffirmer le caractère volontaire et gratuit de la vaccination.
• Réfléchir à un élargissement de la vaccination en phase 1 au personnel des EHPAD qui le souhaite, et pas seulement à ceux qui présentent des facteurs de risque.
• Ouvrir le plus rapidement possible l'accès à la vaccination aux personnes ciblées au-delà de la phase 1, présentant des facteurs de risque et facteurs d'exposition élevés.
• Affirmer l'importance d'une vaccination des professionnels de santé libéraux, dont les médecins généralistes directement au contact des Français.
• Achever la définition de la chaîne logistique à mettre en place pour stocker et distribuer les vaccins, en respectant les conditions de conservation des lots, en anticipant la question de l'administration de la deuxième dose et en organisant l'élimination des déchets.
• Ne pas se précipiter pour la réalisation de la première phase, et définir un protocole pour le recueil du consentement dans les EHPAD qui pourrait prendre appui sur une fiche d'aide à la décision et au consentement.
• S'appuyer de manière privilégiée sur les professionnels de santé de ville pour réaliser les vaccinations à partir de la 2 ème phase, en leur fournissant au préalable une information complète sur les vaccins et le processus de vaccination, afin qu'ils puissent être les référents de leurs patients en matière d'information sur la vaccination.
• Sécuriser juridiquement l'intervention des professionnels de santé vaccinateurs en prenant un arrêté ministériel prévoyant l'intervention de l'ONIAM pour l'indemnisation des accidents de vaccination.
• Construire un système d'information simple et complet afin de tracer l'ensemble des vaccinations opérées et remonter en temps réel les effets indésirables.
3. Axe 3 - La dimension économique, industrielle et financière
• Doter l'Union européenne d'une agence sur le modèle de la BARDA américaine, capable d'investir massivement, sous la forme de partenariats public-privé, dans le développement initial et la production de médicaments stratégiques, et chargée de constituer des stocks mutualisés au niveau européen.
• Pérenniser l'Instrument d'aide d'urgence (IAU) sous la forme d'un fonds d'investissement d'urgence européen, alimenté par les États-membres et disposant, en cas de crise sanitaire, de la capacité d'intervenir immédiatement et massivement pour soutenir le développement initial et la production des médicaments.
• Pérenniser la politique européenne de mutualisation des achats de médicaments stratégiques et autres dispositifs médicaux, grâce à une équipe dédiée associant la Commission européenne et des experts issus des États-membres qui le souhaitent.
• Instituer un registre public européen des contrats signés par les États-membres ou la Commission européenne pour la fourniture de produits pharmaceutiques. Les contrats échus seraient librement consultables dans des conditions et après un délai à définir.
4. Axe 4 - Covid-19 : défiance de la population, défi de la vaccination
• Adopter une démarche ambitieuse et concrète de transparence dans la définition et la mise en oeuvre de la stratégie de vaccination, tant au niveau de l'action que de la communication, afin de rétablir la confiance nécessaire en s'appuyant sur un canal d'information simple, clair et accessible tel qu'un portail unique fournissant une synthèse de l'ensemble des informations disponibles (par exemple le site https://vaccination-info-service.fr ), dont celles relatives aux vaccins et à leurs effets, aux modalités de la stratégie vaccinale et à sa gouvernance.
• Prévenir et lutter contre les conflits d'intérêt, en rendant obligatoire la déclaration d'intérêts de l'ensemble des personnes qui interviennent dans le champ de la stratégie vaccinale et en amplifiant la visibilité des initiatives du type du site https://www.transparence.sante.gouv.fr .
• Utiliser les acquis des sciences humaines et sociales pour mieux mettre en oeuvre la stratégie de vaccination, notamment la sociologie politique et la sociologie cognitive. Le rôle des personnes vaccinées a ainsi été identifié comme un facteur facilitant et des collectifs d'ambassadeurs du vaccin devraient être mis en place avec des personnalités publiques et des citoyens volontaires.
• S'appuyer sur les professionnels de santé, acteurs privilégiés pour améliorer l'adhésion vaccinale de manière significative dans la population.
• Renforcer la pharmacovigilance et ses dispositifs en les faisant mieux connaître à l'image du site https://signalement.social-sante.gouv.fr dont une synthèse des résultats devrait figurer sur le portail unique dédié à la vaccination.
• Réaffirmer le rôle du Parlement, des élus locaux dont les maires, des corps intermédiaires et, en particulier, des institutions de la démocratie sanitaire dans la stratégie vaccinale, en veillant à ce que le recours à des comités de citoyens tirés au sort leur soit complémentaire, ne les contourne pas ni ne s'y substitue.
• Adopter un calendrier de vaccination réaliste évitant la précipitation et le risque sous-jacent de défiance ; la date du 4 janvier 2021 pour démarrer la première phase de vaccination ne doit pas être fétichisée.
EXAMEN DU RAPPORT PAR L'OFFICE
L'Office parlementaire d'évaluation des choix scientifiques et technologiques s'est réuni le mardi 15 décembre 2020 pour examiner le rapport portant premières conclusions sur « La stratégie vaccinale contre la Covid-19 » présenté par ses rapporteurs Mmes Sonia de La Prôvoté et Florence Lassarade, sénatrices, et MM. Jean-François Eliaou et Gérard Leseul, députés.
M. Cédric Villani, député, président de l'Office . - À la fin du mois de novembre, le Président de l'Assemblée nationale et le Président du Sénat ont souhaité que l'OPECST joue pleinement son rôle en examinant la stratégie vaccinale visant à lutter contre l'épidémie de Covid-19. Depuis, la commission des affaires sociales de l'Assemblée nationale nous en a officiellement saisis. Je remercie les quatre rapporteurs pour la rapidité avec laquelle ils ont réalisé la première phase de leur travail. L'Office a su être au rendez-vous et son action permet que le débat qui va avoir lieu devant chacune des assemblées cette semaine soit le plus objectif possible et ne soit pas otage de démarches tactiques ou politiciennes.
Je tiens d'abord à souligner que le développement, la fabrication et la mise à disposition rapide de vaccins contre la Covid-19 sont une réelle prouesse scientifique et technologique. Notre impression globale est que la stratégie vaccinale annoncée va dans le bon sens. Nous avons identifié des points de vigilance, des choses qui auraient pu être mieux faites, d'autres qui s'annoncent comme des points de fragilité, mais aucune erreur majeure n'a été mise en évidence à ce stade.
M. Gérard Longuet , sénateur, premier vice-président de l'Office . - Je salue la profondeur et le sérieux des travaux menés sur la stratégie vaccinale par nos quatre rapporteurs, sous la houlette du président Cédric Villani. Je suis en accord complet avec leur deuxième recommandation qui propose de réaffirmer le rôle du Parlement et la place de la démocratie sanitaire. Faire confiance aux institutions, et en particulier au Parlement, doit réjouir ceux qui sont attachés à une pratique responsable de la démocratie.
M. Gérard Leseul, député, rapporteur . - Nous sommes convenus que je présenterai la dernière partie du rapport. La stratégie de vaccination doit relever de nombreux défis : scientifiques, médicaux, logistiques, économiques. Mais il y a aussi un défi très important : celui de l'acceptabilité sociale et de l'acceptabilité individuelle, car si elles font défaut, la stratégie de vaccination ne fonctionnera pas. Nos auditions ont permis de mettre en évidence les freins à la vaccination. Le frein principal est psychologique, eu égard aux incertitudes qui pèsent sur les bénéfices individuels attendus, mais aussi à une forte défiance vis-à-vis de la parole politique, qui s'explique notamment par le cafouillage intervenu sur les masques dans une phase précédente de la crise.
Le projet de rapport avance plusieurs recommandations. Il convient de renforcer la place de la parole médicale, en particulier dans le cabinet du médecin, dans la relation quasi familiale que chacun établit avec son médecin traitant. Il faut aussi garantir une explication transparente de la stratégie vaccinale, car l'opacité est un problème. La transparence doit porter sur tout : sur le rôle de chaque acteur de la chaîne de vaccination, sur les contrats avec les laboratoires ou encore sur l'information des citoyens. On demande la vérité sur ce que l'on sait, et sur ce que l'on ne sait pas. L'une des recommandations consiste à mettre à disposition du public un site d'information centralisé, pouvant le cas échéant renvoyer vers des sites plus complets. Nous suggérons aussi de constituer un collectif d'ambassadeurs qui auraient pour mission d'expliquer la stratégie de vaccination. Enfin, les personnels de santé devraient être encouragés à se faire vacciner, ce qui entraînera le grand public à se faire vacciner à son tour. Le fait que le personnel de santé soit lui-même vacciné rassurera les familles des résidents des EHPAD. Enfin, la parole médicale rassurera davantage que la parole politique.
M. Cédric Villani, député, président de l'Office . - Merci à Gérard Leseul pour cette présentation d'une condition essentielle de réussite de la stratégie vaccinale. Je peux témoigner que, médecins ou pas, les rapporteurs ont travaillé en très bonne entente.
M. Jean-François Eliaou, député, rapporteur . - Je veux d'abord souligner que ce travail a été un travail d'équipe. Je vais présenter le premier axe, qui traite des connaissances et des incertitudes scientifiques. La Covid-19 est une maladie particulièrement polymorphe, dans ses atteintes et sa symptomatologie. C'est important car cela pose la question de la justification de la vaccination et des mesures sanitaires. Les jeunes y sont assez réticents car ils font en général des formes asymptomatiques de la maladie et ils n'en meurent quasiment pas. Il faut souligner que la gravité de la maladie augmente considérablement avec l'âge : 8 % de létalité pour les plus de 80 ans.
Même si les connaissances sur la maladie ont progressé, la réponse immunitaire contre le virus reste mal connue. On a donc des difficultés à bien appréhender l'arrière-plan de la vaccination. Or celle-ci est un moyen d'éradiquer les maladies infectieuses graves - il ne faut pas hésiter à le rappeler - mais elle se base justement sur la réponse immunitaire, c'est-à-dire la capacité de l'organisme à se défendre contre le virus. Des travaux scientifiques commencent à apporter des réponses, la connaissance est en construction et il y a encore des débats. Or, nous avons besoin de bases solides pour anticiper la réponse du système immunitaire à la vaccination.
Je rappelle que pour éradiquer une maladie infectieuse, un vaccin doit à la fois prévenir les formes graves et empêcher la propagation du virus. Or nous ne savons pas si la vaccination contre la Covid-19 est stérilisante, c'est-à-dire si elle empêche la propagation du virus d'homme à homme. C'est un point important car si tel n'est pas le cas, il faudra maintenir les gestes barrière malgré la vaccination, ce qui risque d'être mal accepté par nos concitoyens.
La stratégie vaccinale qui a été adoptée par le gouvernement, éclairé par des avis scientifiques, notamment la Haute Autorité de santé, est progressive, ce qui est une bonne chose, et prend en compte la balance bénéfices-risques. Cette stratégie est donc un choix responsable du gouvernement. Le risque d'effets indésirables, rares mais toujours possibles, doit être pris en compte et comparé aux bénéfices associés à la vaccination. La population pour laquelle cette balance est la plus favorable est celle des personnes âgées, car elles sont ainsi protégées des formes sévères, mortelles. Chez les jeunes, les bénéfices sont moins évidents, dans la mesure où les formes sévères sont extrêmement rares dans cette classe d'âge.
S'agissant des effets indésirables, on a vu apparaître deux cas de réaction allergique grave au Royaume-Uni. Cela souligne l'importance d'une pharmaco- ou vaccino-vigilance très serrée. Ce besoin de transparence est développé dans le quatrième axe du rapport, qui montre la nécessité d'une bonne communication de l'information disponible. Un site internet complet et transparent pourrait servir à cela.
La question de la responsabilité des vaccinateurs doit être anticipée, dans la mesure où la vaccination ne sera pas obligatoire. La responsabilité sans faute du vaccinateur peut être engagée ; c'est pourquoi le ministère doit prendre les mesures nécessaires.
Pour conclure, je rappelle que le rôle dévolu au Parlement, et à l'Office qui est son bras armé dans le domaine scientifique, par l'article 24 de la Constitution oblige à être particulièrement vigilant et à accomplir notre mission de contrôle et d'évaluation des politiques publiques et de l'action du gouvernement.
Mme Sonia de La Provôté, sénatrice, rapporteure . - Alors que nous ne disposions que d'informations très partielles au début de notre travail, nous avons pu, en une dizaine de jours, nous faire une opinion sur des sujets complexes, grâce aux nombreuses auditions menées.
S'agissant de l'axe relatif aux aspects logistiques de la
stratégie de vaccination, c'est d'abord la question de la gouvernance
qui est apparue comme l'un des principaux écueils. De nombreuses
structures interviennent directement dans la décision : la Haute
Autorité de santé (HAS) pour les recommandations en
matière de vaccins, l'Agence nationale de sécurité du
médicament (ANSM) pour la pharmacovigilance, mais aussi Santé
publique France (SPF)
- dont, je tiens à le signaler ici, nous
n'avons pas pu entendre les responsables -, le directeur
général de la Santé (DGS) Jérôme Salomon,
etc.
Viennent s'y adjoindre un grand nombre d'organismes consultatifs. Encore le terme « consultatif » n'est-il pas totalement satisfaisant, car plusieurs structures semblent participer à la décision, en matière scientifique, en matière de négociation avec les laboratoires, ou encore en matière logistique - c'est le cas de la task force rattachée au ministre de la santé, que nous n'avons pas pu entendre non plus. Vous trouverez un panorama de l'ensemble de ces acteurs dans le schéma « synthétique » présenté en annexe au rapport.
M. Cédric Villani, député, président de l'Office . - Encore n'a-t-on pas inclus, dans ce schéma, les acteurs dont le rôle exact ne nous a pas semblé très clair pour l'instant, tels que le comité citoyen.
Mme Sonia de La Provôté, sénatrice, rapporteure . - De nombreuses personnalités sont présentes dans ces différentes structures - parfois dans plusieurs simultanément. Tout cela forme en définitive une comitologie très complexe. De plus, les prises de parole n'étant pas toujours coordonnées, le message a parfois été brouillé - même si chacun reste dans son rôle, les aspects scientifiques différant des aspects logistiques. Enfin, les relations établies entre toutes ces structures ne sont pas claires.
Dans la période qui s'ouvre, une parole forte, cohérente et compréhensible par tous sera indispensable. Cette remarque vaut pour l'ensemble des politiques sanitaires, mais plus encore dans la crise que nous vivons. Le Gouvernement doit donc se préoccuper de répondre à plusieurs questions : qui va communiquer ? Quelles sont les missions de chacun ? Les membres des différentes structures ont-ils travaillé pour un laboratoire pharmaceutique, ou dans tel ou tel champ de recherche ?
S'agissant de la stratégie vaccinale elle-même, plusieurs paramètres dépendent directement des choix du gouvernement.
Tout d'abord, la quantité de doses disponibles. Les territoires seront livrés progressivement, et le cabinet du ministre nous a indiqué qu'il serait sans doute nécessaire d'établir des priorités à un niveau très fin, au risque de devoir expliquer à un EHPAD qu'il ne sera pas livré alors que le sera un autre établissement situé sur le même territoire.
Ensuite, la communication. Celle-ci doit être progressive, s'adapter aux événements et ne pas s'en tenir à une « bande-annonce » immuable. D'ailleurs, les dates annoncées par le gouvernement pour la phase 1 et pour la phase 2 pourraient évoluer.
Quant au caractère facultatif de la vaccination, il existe un consensus d'autant plus justifié qu'il demeure des incertitudes sur le caractère bloquant, neutralisant, des anticorps et sur les éventuels effets secondaires - rares - qui pourraient apparaître lors de la vaccination d'un grand nombre de personnes.
Un consensus existe également sur la priorité donnée aux personnes âgées vulnérables. Cette priorité n'est contestée que par ceux qui y voient une volonté de « tester » le vaccin sur les plus âgés avant de prendre des risques pour les autres. En réalité, l'objectif de cette première phase n'est pas de stopper la propagation de l'épidémie, mais bien de protéger les plus vulnérables afin de soulager les services hospitaliers dans l'hypothèse où ceux-ci devraient faire face à une nouvelle vague. En effet, si la durée d'immunité procurée par le vaccin n'est pas bien connue, elle sera en tout état de cause suffisante dans ce cas de figure et les personnes âgées seront protégées si une troisième vague devait survenir.
La priorité donnée à la vaccination dans les EHPAD et les structures équivalentes est justifiée car ce sont fréquemment des foyers épidémiques. Le virus s'y diffuse très vite et y a parfois touché jusqu'à 60 % des résidents.
Le caractère volontaire de la vaccination ne doit pour le moment pas être remis en cause, même s'il pose des difficultés juridiques et pratiques. Par ailleurs, si le médecin traitant n'est pas convaincu de l'utilité de la vaccination, il lui sera difficile de convaincre son patient. Il faut donc se mettre en mesure de vacciner largement les professionnels de santé qui le souhaitent. Un certain nombre de professionnels souhaitent le faire, notamment dans les EHPAD, afin d'entraîner leurs patients dans cette dynamique.
La bonne performance de la chaîne logistique dans la première phase est une condition de réussite de la stratégie vaccinale : en cas d'échec, il serait difficile d'élargir la vaccination à toutes les personnes âgées. À partir du moment où la vaccination ne concernera plus seulement les EHPAD - qu'il est aisé de localiser et où il est facile de compter les volontaires -, sa diffusion territoriale causera une grande complexité. Par ailleurs, le vaccin à ARN de Pfizer-BioNtech est très fragile. Il doit en effet être conservé à -70 °C et ne peut pas être transporté pendant plus de douze heures au total, cette durée incluant l'acheminement du lieu de centralisation des vaccins vers la pharmacie référente. Une fois la dose livrée, elle doit être utilisée dans un délai de cinq jours. Le conditionnement étant multidose, une fois le flacon ouvert, on dispose en fait de six heures pour utiliser toutes les doses. C'est une contrainte logistique très forte qui nécessite un enchaînement linéaire et fluide.
Pendant la première phase, une attention toute particulière devra être prêtée au recueil du consentement du résident, qui doit être éclairé et explicite. Lorsque le patient n'est pas capable de le délivrer, on passe par un tiers de confiance. Il faut clarifier rapidement le caractère oral ou écrit du consentement. Il nous a été dit que le consentement serait oral, mais les professionnels pourraient exiger plutôt un consentement écrit pour se protéger.
La vaccination doit s'appuyer sur les professionnels de santé de ville. Ce n'est pas ce qui avait été fait lors de l'épidémie de grippe H1N1 car des vaccinodromes avaient été mis en place. Aujourd'hui, compte tenu de la situation - nouveau vaccin, nouveau virus - l'intervention du médecin traitant, dans sa relation singulière avec le patient, est essentielle pour convaincre les indécis et faire réussir la stratégie vaccinale. La réussite passe aussi par une pharmacovigilance renforcée, claire et explicite pour chacun.
Les professionnels de santé n'ont pour l'heure pas reçu d'informations précises sur la vaccination. Si le calendrier est respecté, ils seront amenés, dès le 4 janvier, à recueillir les consentements et à réaliser les injections. Ils souhaitent obtenir des clarifications quant aux possibilités de mise en cause de leur responsabilité, sachant qu'a été insérée dans les contrats européens une clause d'irresponsabilité des laboratoires. Participant à une mission de santé publique d'intérêt national, ils attendent donc qu'un arrêté ministériel les protège afin que de potentiels accidents de vaccination ne leur soient pas imputés. Ils comprennent l'importance de la vaccination mais demandent à être protégés.
Après l'audition du directeur-adjoint du cabinet du ministre des solidarités et de la santé que nous avons organisée hier soir, il reste à clarifier la « logistique du dernier kilomètre ». Le moindre hiatus dans la chaîne d'approvisionnement risquerait de rendre le vaccin inefficace. Pour éviter cela, il faut des procédures écrites, précises et territorialisées. Par ailleurs, les maires semblent peu informés alors que nous avons la conviction qu'ils sont des vecteurs très importants d'adhésion. Ils doivent donc faire partie de la boucle d'information et de communication.
M. Cédric Villani, député, président de l'Office . - Merci beaucoup. Nous en arrivons à l'axe du rapport qui traite de la dimension industrielle et contractuelle de la stratégie vaccinale.
Mme Florence Lassarade, sénatrice, rapporteure. Il y a quelques mois, on ne savait rien de ce qui allait sortir du « chaudron de préparation des vaccins ». La surprise a été relativement bonne. Elle permet enfin d'envisager une sortie de la pandémie. Ce que nous n'avons pas encore évoqué ce matin est le fait que le premier vaccin sera administré en deux doses, délivrées à trois semaines d'intervalle, et qu'on ne peut pas envisager de réaliser la première injection tant qu'on n'est pas certain d'avoir la seconde dose.
L'Union européenne a eu une attitude positive et collective : elle a fait une précommande de 1,3 milliard de doses pour un coût de 12 milliards d'euros dont 1,8 milliard pour la France, correspondant à 200 millions de doses. Ce nombre permettra de combler les probables pertes liées au conditionnement en flacons multidoses.
Le projet de rapport présente plusieurs tableaux, dont une comparaison entre la France, le Royaume-Uni et les États-Unis. On peut noter une différence de prix, peu explicable, entre ce qui a été proposé à l'Union européenne et aux États-Unis : le coût moyen d'une dose est 7,50 euros pour les États-Unis et 9 euros pour l'Union européenne. Le Royaume-Uni, pour des raisons que l'on comprend, n'a pas communiqué sur les prix qu'il a acceptés. Il a vraisemblablement payé très cher, pour des raisons politiques. Le Royaume-Uni a choisi une stratégie autonome, guidée par la rapidité. Ils ont pris un risque économique et sanitaire élevé. Les États-Unis ont payé leurs doses 20 % de moins que nous. Ils se sont fortement investis sur le développement initial des vaccins avec la Biomedical Advanced Research and Development Authority (BARDA). L'Union européenne manque d'un tel outil.
Nous recommandons justement que l'Europe se dote d'une agence similaire, capable d'investir massivement, sous la forme de partenariats public-privé, dans le développement initial et la production de médicaments stratégiques. Elle serait chargée de constituer des stocks mutualisés au niveau européen.
Un laboratoire européen, AstraZeneca, est allé jusqu'au bout des essais cliniques et a été très performant dans la production d'un vaccin somme toute assez classique, alors que Pfizer et Moderna ont eu l'audace de développer un vaccin à ARN qui s'est révélé beaucoup plus rapide à mettre au point et capable d'être produit en masse. Ce n'est pas sans incidence sur le choix stratégique de vaccination en France car, même si la réponse immunitaire diminue avec l'âge, ce vaccin à ARN est malgré tout est efficace à 95 %.
M. Jean-François Eliaou, député, rapporteur . - J'attire l'attention sur une confusion fréquente : l'ARN du vaccin n'est pas un ARN messager, comme on le dit souvent, mais un ARN synthétique, qui a la même forme et la même séquence. C'est un ARN de synthèse.
Mme Florence Lassarade, sénatrice, rapporteure . - L'Europe n'a pas eu l'audace de consentir, comme l'ont fait les États-Unis, un investissement massif sur cette technique. Le projet de vaccin de Sanofi est également très classique avec l'intervention d'un recombinant. On n'a pas eu d'audace industrielle vis-à-vis des vaccins. En s'appuyant sur l'équivalent de la BARDA américaine, l'Europe aurait peut-être été plus performante.
Nous recommandons de pérenniser l'Instrument d'aide d'urgence (IAU) sous la forme d'un fonds d'investissement d'urgence européen, alimenté par les États membres et disposant, en cas de crise sanitaire, de la capacité d'intervenir immédiatement et massivement pour soutenir le développement et la production des médicaments. Nous recommandons aussi de pérenniser une politique européenne de mutualisation des achats de médicaments stratégiques et autres dispositifs médicaux, qui pourrait reposer sur le travail conjoint de la Commission européenne et d'experts issus des États membres qui le souhaitent.
En matière budgétaire, on peut réfléchir à l'opportunité de se lancer dans des achats massifs de vaccins - souvenons-nous qu'en 2009, Roselyne Bachelot avait été très attaquée sur ce sujet. Nous souhaitons qu'à la fin de la campagne vaccinale de la première année, la transparence puisse être faite sur les tenants et aboutissants des négociations avec les laboratoires. Ces informations sont pour l'instant confidentielles.
Nous allons entrer dans la première phase de vaccination. La campagne touchera progressivement toute la population, par tranches, mais on ne sait pas si la maladie disparaîtra car le vaccin protège des formes graves, mais pas forcément de la transmission. On peut faire le parallèle avec le vaccin polio allégé disponible dans les pays européens ; dans les pays exposés, on fait un vaccin différent, buvable, de façon à bloquer également la transmission. Nombre de scientifiques annoncent la multiplication à venir des pandémies. Il faut donc envisager d'être à nouveau confronté à des campagnes de vaccination similaires, pour la Covid-19 ou pour des maladies équivalentes. C'est pourquoi il est indispensable d'avoir davantage de transparence sur la façon dont sont négociés les achats de vaccins.
Pour conclure, il apparaît qu'en cas de crise sanitaire majeure, deux types de mesures qui ne s'improvisent pas permettent à l'État de garantir un approvisionnement en médicaments ou en vaccins :
- l'investissement direct qui donne un droit de regard sur les produits, les prix, les lieux de production ; cela rejoint l'idée déjà évoquée d'une « BARDA européenne » ;
- des mesures éventuellement contraignantes, avec obligation faite aux laboratoires de constituer des stocks de produits stratégiques. Ce point fait l'objet de débats mais est-ce qu'il ne faudrait pas stocker des vaccins, compte tenu des incertitudes sur la durée de protection vaccinale ? Pour le moment deux doses sont nécessaires, et peut-être nous dira-t-on dans quelques mois qu'une seule dose suffit, mais dans l'incertitude, ayons la capacité de constituer des stocks pour les crises à venir.
M. Cédric Villani, député, président de l'Office . - Nous en avons terminé avec la présentation des quatre axes du rapport. J'insiste sur le fait que ces quatre axes forment un ensemble très complet : les questions scientifiques, les questions de mise en oeuvre, les enjeux économiques et géopolitiques et, enfin, la question de la confiance. Si les analyses et les recommandations sont bien distinctes, elles dressent, ensemble, un panorama exhaustif.
M. Gérard Longuet , sénateur, premier vice-président de l'Office . - J'aimerais obtenir des éclaircissements sur trois sujets :
- est-ce que le rapport présente une typologie des vaccins afin d'expliquer aux parlementaires et au grand public les différents types de vaccins proposés ?
- Sanofi a fait le choix d'un vaccin classique mais apparaît en retard ; comment l'expliquer ?
- la BARDA a permis aux États-Unis d'investir dans les vaccins. Pourquoi ? Selon quels critères ? Dans quelles conditions ? Lorsque vous dites qu'un tel organisme serait bienvenu au niveau européen, comment imaginer une telle logique d'investissement dans un monde aussi spécialisé et technique, où les grands acteurs mondiaux peuvent avoir des intérêts si différents ?
Cette dernière question fait d'ailleurs écho à la première : la diversité des vaccins correspond-elle à des voies qui s'opposent ou à des voies qui se succèdent, entre ce qui est plus ou moins mûr, plus ou moins prometteur, voire plus ou moins sûr ?
Mme Michelle Meunier , sénatrice . - On a beaucoup parlé des EHPAD mais n'oublions pas qu'en France, les trois quarts des personnes dépendantes vivent à leur domicile, qui est le lieu de tous les possibles, le meilleur comme le pire. Ces personnes dépendantes reçoivent la visite de bénévoles, de voisins, qui apportent le repas, vont chercher le courrier, entrent et sortent. On sait que c'est là que se situe le danger en termes sanitaires. Quelles recommandations faut-il faire, au-delà des soignants, pour tous ces aidants et toutes ces personnes ?
M. Pierre Henriet, député . - Je veux revenir sur le sujet important de la défiance. Une partie de la population ressent l'hésitation vaccinale et un récent sondage affirme que seuls 41 % des Français sont prêts à se faire vacciner. Avons-nous des données plus précises sur ces populations - je pense notamment au fait que les jeunes générations souhaitent moins utiliser le vaccin. Quand on regarde les taux de létalité, il est vrai que c'est la partie plutôt âgée de la population qui est la plus concernée par le danger, cela explique peut-être pourquoi une partie de la population hésite. De plus, vous le notez bien dans le rapport, on est dans l'ère du soupçon et cela renvoie au sujet plus général de la confiance des Français dans les scientifiques. L'Office pourrait y travailler, au-delà du traitement de la crise sanitaire.
Mme Catherine Procaccia , sénateur, vice-présidente de l'Office . - Vous nous avez tous les quatre appris des choses passionnantes, mais on ne sait pas tout actuellement, ce qui ne va pas aider à rassurer la population.
Il me semble très important de relever qu'on ne peut pas injecter la première dose avant d'être sûr de disposer de la seconde. Or la France ne disposera pas de toutes les doses dans l'immédiat. Les EHPAD et ceux qui vont organiser la campagne sur le terrain sont-ils bien conscients de cela ? C'est un point sur lequel il faut absolument insister : mieux vaut vacciner moins mais vacciner mieux, c'est-à-dire être sûr que c'est efficace.
M. Cédric Villani, député, président de l'Office . - Merci à tous. Je propose que les rapporteurs nous fassent part de leurs éléments de réponse.
M. Jean-François Eliaou, député, rapporteur . - Je vais d'abord essayer de répondre aux questions de Gérard Longuet.
Sanofi est à la phase 1 des essais, avec des résultats mitigés. À cet égard, la deuxième question posée est essentielle, parce que l'Europe, en particulier la France, est très en retard sur l'investissement dans la R&D et l'innovation. Ce n'est pas la première fois qu'on s'en aperçoit. Aucune molécule d'intérêt - c'est-à-dire susceptible de devenir un médicament - découverte en France - j'en ai découvert deux - n'a pu être ou ne sera commercialisée par l'industrie française.
Ce constat ne traduit pas une faiblesse scientifique, au sens d'« intellectuelle », des Français ou des Européens, mais l'absence de stratégie de soutien de la puissance publique à la R&D. Avec la BARDA, le gouvernement des États-Unis a investi des milliards de dollars - la Chine fera de même -, y compris sur Moderna, une entreprise au siège social américain mais dirigée par un Français. Cela ne leur fait pas peur. Les Américains peuvent investir plus de deux milliards sur un projet, éventuellement à fonds perdus puisqu'il s'agit d'un pari. Le prix d'achat des vaccins tient compte en partie de ces investissements. Nous n'avons pas cette puissance de feu. Il faut tirer des événements actuels une leçon sur notre capacité à faire face à une crise sanitaire de cette ampleur, notamment en mettant en place en Europe l'équivalent de la BARDA.
À mon avis, les vaccins à ARN sont arrivés les premiers simplement parce que le séquençage du génome viral a été extrêmement rapide. Ce n'est pas étonnant, parce que les capacités de séquençage sont devenues considérables. À partir du moment où, d'une part, on a séquencé la forme principale du virus très rapidement - trois semaines après le début de la pandémie - et, d'autre part, nous connaissions les mécanismes d'action des coronavirus en général, notamment celui de l'entrée du virus dans la cellule par la protéine Spike, il suffisait d'identifier sur le génome les séquences codant cette protéine, de les copier, et d'en faire la synthèse pour produire un vaccin. Le patron de BioNTech a pensé en une nuit la stratégie qu'il a adoptée pour son vaccin. Il est donc normal que ces vaccins arrivent plus vite sur le marché. Les vaccins traditionnels nécessitent plus de travail. Ainsi, l'Institut Pasteur part d'un modèle de vaccin contre la rougeole, ce qui peut poser plus de problèmes et, éventuellement, produire plus d'effets indésirables.
C'est une très bonne chose que les vaccins arrivent progressivement, car cela permettra très vraisemblablement de disposer de vaccins de technologies différentes, donc avec des indications différentes, des effets indésirables plus ou moins importants, des inductions d'immunité variables, etc. Par exemple, les vaccins à ARN pourraient s'avérer plus adaptés à la population âgée ou très âgée qu'à la population jeune, parce qu'ils induiraient chez celle-ci plus d'effets indésirables. Ce sera la même situation que pour les médicaments : on disposera d'une panoplie et le vaccin injecté ne sera pas identique pour tous.
Par ailleurs, la progressivité permet aussi d'apprendre et de s'adapter. Les chercheurs de l'Institut Pasteur ont vu que ce qu'ils avaient programmé n'était pas forcément en adéquation avec les effets indésirables qu'ils anticipaient sur d'autres vaccins.
L'OPECST a publié il y a environ un an un excellent rapport de Florence Lassarade, Cédric Villani et moi-même sur l'hésitation vaccinale. Le fait que, pour la Covid-19, la vaccination soit destinée aux adultes et non aux enfants est fondamental. Quand on vaccine ses enfants, on n'a pas envie de les mettre en danger. Nous ne nous trouvons pas dans ce cas de figure. L'hésitation vaccinale doit être prise en compte, parce qu'il s'agit de se protéger soi-même pour protéger les autres. C'est donc une démarche individuelle à visée collective, comme pour la vaccination contre la grippe.
Mme Florence Lassarade, sénatrice, rapporteure . - Les vaccins à ARN n'utilisent pas des méthodes inconnues, puisque le Téléthon et le Généthon les ont beaucoup développées, même si ce n'est pas pour lutter contre les infections virales. Ces techniques existent depuis plusieurs dizaines d'années. Elles ont déjà été utilisées pour le traitement de certaines tumeurs cancéreuses. Cependant, les utiliser pour la vaccination était quand même un pari, heureusement réussi. Quelles que soient les sommes investies dans la recherche, les paris scientifiques peuvent aussi bénéficier - ou pas - d'une dose de réussite. Au fil des auditions, nous avons compris que Sanofi n'a pas pu se lancer dans des technologies innovantes. Or, mettre au point un vaccin recombinant nécessite probablement beaucoup de temps, parce que la démarche oblige à tâtonner pour trouver la bonne cible permettant d'obtenir un vaccin efficace. Il faut des essais, des allers-retours, et c'est beaucoup plus empirique que pour les autres techniques.
Mme Sonia de La Provôté, sénatrice, rapporteure . - Ce sont surtout les jeunes qui montrent un scepticisme vaccinal. Il s'agit bien de scepticisme et non d'un positionnement « anti-vax », qui est quasiment une religion, avec une telle irrationalité que tout combat par la raison paraît difficile à conclure. L'objectif est donc d'amener à la vaccination ceux qui sont sceptiques. Or ce scepticisme ne touche pas nécessairement les autres vaccinations : de nombreuses personnes qui d'ordinaire ne se faisaient pas vacciner contre la grippe l'ont fait cette année, parce qu'elles ont compris que le bénéfice de la vaccination était supérieur au risque encouru de son fait. Dans la pédagogie vaccinale, le sujet de la balance bénéfice - risque est très important, en plus de la transparence et de la façon de communiquer. Les femmes doutent plus, ont dit des sociologues lors des auditions. La catégorie sociale joue aussi : plus les ressources du ménage sont faibles, plus le scepticisme vaccinal augmente. Les sociologues évoquaient aussi la notion de politisation : plus on se situe à un extrême politique, plus on va vers le scepticisme vaccinal.
Mme Florence Lassarade, sénatrice, rapporteure . - On observe effectivement un certain parallélisme entre rejet du politique et rejet du vaccin. Ces populations se recoupent.
Mme Sonia de La Provôté, sénatrice, rapporteure . - Par conséquent, il faut adopter des stratégies de communication adaptées, reposant sur des vecteurs spécifiques, qu'il faut démultiplier. Il faut recommander de s'appuyer sur les élus locaux, principalement le maire : si on mobilise le maire, la politique vaccinale gagne en crédibilité.
La vaccination des personnes dépendantes résidant à domicile relève de la phase 2 de la campagne vaccinale. À ce jour, on ne dispose pas de calendrier très précis. En effet, la phase 1 présente déjà de nombreux défis : une distribution nationale dans les différents congélateurs, l'identification de la personne à vacciner, le recueil de son consentement éclairé, la prise en compte du délai de transport, de préparation puis de vaccination puis, vingt-et-un jours plus tard, l'administration d'une seconde dose. Il faudrait d'ailleurs que les EHPAD aient la garantie que toute la chaîne logistique, y compris la distribution de la seconde dose, a été prise en compte. Nous avons eu le sentiment que le sujet de cette seconde dose était abordé moins en profondeur.
La bonne gestion des déchets biologiques est également essentielle ; elle sera peut-être moins contraignante en EHPAD que lorsque la population générale sera éligible. Ce sera un coût probablement non négligeable pour les pharmacies, le passé ayant montré que cette exigence de bonne gestion n'était pas toujours bien prise en compte.
M. Jean-François Eliaou, député, rapporteur . - Absolument !
Mme Sonia de La Provôté, sénatrice, rapporteure . - Pour les personnes à domicile, une telle logistique n'est pas transposable. Nous avons eu des réponses précises et structurées pour la phase 1 de la campagne, mais le degré de précision est moindre pour la phase suivante, marquée par une bascule annoncée vers la médecine générale, les pharmacies de ville et les cabinets médicaux. Or elle pourrait venir vite si l'on se tient au calendrier de la HAS. Le conditionnement du vaccin en flacons multidoses pose également des contraintes, car dans la vaccination à domicile, une partie des doses pourrait devenir inexploitable. Ainsi, la logistique de la deuxième phase est un sujet tout aussi délicat, qui nécessite des réponses claires.
Pour les Outre-mer, nous avons encore moins de réponses, y compris pour ce qui est de la problématique cruciale du temps de transport. Je rappelle que l'ARN de synthèse n'est plus stable au bout de 12 heures de transport.
La vaccination des personnes dépendantes résidant à domicile va obliger à établir une cartographie préliminaire : il faut commencer à identifier les personnes à vacciner, le médecin traitant et la personne qui va vacciner.
Les EHPAD nous ont semblé prêts à s'intégrer pleinement à la chaîne logistique. Deux interrogations subsistent. Il s'agit d'abord du souhait d'un consentement qui soit donné sous forme écrite et non orale - les médecins et vaccinateurs veulent également cette assurance. Pourquoi échapperions-nous au recueil d'un consentement éclairé écrit ? Ce n'est pas illogique et cela a déjà été mis en oeuvre par le passé. La deuxième interrogation concerne la vaccination des personnels, dont bon nombre sont très hésitants. La représentante du Synerpa a fait état d'un sondage montrant que cette hésitation, voire cette résistance, était plus importante qu'en population générale. Il faudra convaincre ces personnels car ils sont des relais d'opinion au sein des structures et vis-à-vis des familles. C'est la raison pour laquelle nous proposons que les personnels puissent, s'ils le désirent, se faire vacciner dès le début de la campagne afin d'entraîner la population et de réduire le scepticisme vaccinal. Il en est de même pour les médecins généralistes, qui se doivent de montrer une certaine exemplarité. Tous les leviers au service d'un message positif - plus de confiance et moins de scepticisme - nous semblent essentiels à actionner.
M. Cédric Villani, député, président de l'Office . - Merci beaucoup pour ces réponses très précises.
Mme Catherine Procaccia, sénateur, vice-présidente de l'Office . - Comment allez-vous exploiter ce travail ? Ces informations vont-elles être transmises au gouvernement avant le débat ? Après le débat ?
M. Cédric Villani, député, président de l'Office . - Une conférence de presse aura lieu cet après-midi pendant laquelle les quatre rapporteurs s'exprimeront en visioconférence. Une fois adopté, dans quelques instants, le rapport sera communiqué aux présidents des deux assemblées. Demain et après-demain, chaque rapporteur pourra s'exprimer dans le temps de parole de son groupe politique, à l'Assemblée et au Sénat et l'Office bénéficiera d'un temps de parole spécifique dans nos deux assemblées. J'interviendrai moi-même dans le débat au titre de président de l'OPECST. Cette prise de parole de l'Office dans le coeur du débat est une excellente chose. La communication de nos conclusions sera étendue en direction de l'ensemble du Parlement et du gouvernement.
Chers amis, je vous propose maintenant de donner un satisfecit admiratif aux rapporteurs et d'adopter le rapport, qui ne met pas fin à la mission confiée à l'Office puisque ce sont des « premières conclusions » et que les travaux vont donc se poursuivre dans les mois qui viennent.
M. Gérard Longuet, sénateur, premier vice-président . - Summa cum laude !
M. Cédric Villani, député, président de l'Office . - Un grand merci aux rapporteurs et à vous tous.
L'Office a autorisé à l'unanimité la publication du rapport portant premières conclusions sur « La stratégie vaccinale contre la Covid-19 ».
LISTE DES PERSONNES ENTENDUES PAR LES RAPPORTEURS
Jeudi 3 décembre
11 heures : Audition Virologie (1)
• M. Olivier Schwartz, responsable du laboratoire Virus et immunité au département de virologie de l'Institut Pasteur, directeur scientifique de l'Institut Pasteur
15 heures 30 : Audition Virologie (2)
• Mme Sylvie van der Werf, directrice du département de virologie de l'Institut Pasteur et responsable du Centre national de référence des virus des infections respiratoires
Vendredi 4 décembre
9 heures : Audition Virologie (3)
• M. François Balloux, phylogénéticien, chef de l'équipe Biologie computationnelle du département Génétique, évolution, environnement au University College London
10 heures : Table ronde Immunité
• Pr. Arnaud Fontanet, professeur au Collège de France, responsable du département de santé globale et du laboratoire Épidémiologie des maladies émergentes de l'Institut Pasteur, membre du Conseil scientifique mis en place auprès du gouvernement
• Pr. Samira Fafi-Kremer, professeur de virologie, responsable du service de virologie des Hôpitaux universitaires de Strasbourg
15 heures 30 : Audition Virologie (4)
• M. Jean-Daniel Lelièvre, virologue, chef du service des maladies infectieuses de l'hôpital Henri-Mondor (Créteil), membre de la Commission technique des vaccinations de la Haute Autorité de santé
Mercredi 9 décembre
11 heures : Haute autorité de santé (HAS) (audition publique)
• Pr. Elisabeth Bouvet, membre du Collège de la HAS, présidente de la Commission technique des vaccination
• Mme Michèle Morin Surroca, cheffe du service Évaluation économique et santé publique de la HAS
14 heures 30 : Table ronde Hésitation vaccinale
• M. Jeremy Ward, chercheur au CNRS, sociologue spécialiste de la vaccination
• Mme Françoise Salvadori, maître de conférences en immunologie à l'université de Bourgogne, docteur en pharmacie et docteur ès sciences, spécialiste de la résistance à la vaccination
• M. Laurent-Henri Vignaud, maître de conférences d'histoire moderne à l'Université de Bourgogne, spécialiste de l'histoire des oppositions à la vaccination
16 heures : Table ronde Unions régionales de professionnels de santé (URPS) (audition publique)
• Dr. Antoine Leveneur, président de l'URPS Médecins libéraux de Normandie (« URML Normandie »)
• Mme Isabelle Varlet, présidente de l'URPS Infirmiers libéraux de Nouvelle Aquitaine
• M. François Martial, président de l'URPS pharmaciens de Nouvelle Aquitaine
Jeudi 10 décembre
11 heures 30 : Conseil d'orientation sur la stratégie vaccinale (audition publique)
• Pr. Alain Fischer, président du Conseil d'orientation sur la stratégie vaccinale
14 heures : Agence nationale de sécurité du médicament et des produits de santé (ANSM)
• Dr. Christelle Ratignier-Carbonneil, directrice générale par intérim
• Mme Carole Le Saulnier, directrice des affaires juridiques et règlementaires
• Mme Céline Mounier, directrice de la surveillance
• Dr. Rosemary Dray-Spira, directrice adjointe du Groupement d'intérêt scientifique EPI-PHARE
• M. Alban Dhanani, directeur adjoint des vaccins, des médicaments anti-infectieux, en hépato-gastroentérologie, en dermatologie, de thérapie génique et des maladies métaboliques rares
15 heures : Table ronde Syndicats de médecins
• Dr. Jean-Louis Bensoussan, secrétaire général de MG France (Fédération française des médecins généralistes)
• Dr. Claude Bronner, vice-président de Union Généraliste - Fédération des médecins de France (FMF)
• Dr. Laure Dominjon, présidente du Regroupement autonome des généralistes jeunes installés et remplaçants (ReAGJIR)
• Dr. Sandra Henocq, secrétaire générale du Regroupement autonome des généralistes jeunes installés et remplaçants (ReAGJIR)
• Dr. Philippe Martin, Syndicat national des jeunes médecins généralistes (SNJMG)
• Dr. Jérôme Marty, président de l'Union française pour une médecine libre (UFML)
• Dr. Rémi Unvois, vice-président de la Confédération des syndicats médicaux français (CSMF)
16 heures 30 : table ronde Établissements de soins et d'hébergement
• Synerpa (Syndicat national des établissements et résidences privés pour personnes âgées) : Mme Florence Arnaiz-Maumé, déléguée générale, et Mme Pauline Meyniel, responsable du pôle médico-social
• FHF (Fédération hospitalière de France) : Mme Zaynab Riet, déléguée générale, M. Marc Bourquin, conseiller Stratégie de la délégation générale, et M. Alexandre Mokédé, responsable du pôle Offre de soins
• Fehap (Fédération des établissements hospitaliers et d'aide à la personne privés non lucratifs) : M. Jean-Christian Sovrano, directeur « Autonomie & Parcours de vie »
17 heures 30 : Direction générale de la santé (audition publique)
• P. Jérôme Salomon, directeur général de la santé
Vendredi 11 décembre
9 heures : Comité scientifique sur les vaccins Covid-19 (audition publique)
• Mme Marie-Paule Kieny, président du Comité
• M. Stéphane Paul, professeur d'immunologie au CHU de Saint-Etienne
• M. Bernard Fritzell, consultant indépendant dans le développement clinique des vaccins
• M. Bernard Fanget, consultant en vaccinologie
12 heures 30 : table ronde Usagers du système de santé (audition publique)
• Pr Emmanuel Rusch, professeur des universités-praticien hospitalier, président de la Conférence nationale de santé (CNS), du Comité de contrôle et de liaison Covid-19 et de la Société française de santé publique (SFSP)
• M. Christian Saout, président de la commission sociale et médico-sociale et du conseil pour l'engagement des usagers de la Haute Autorité de santé (HAS)
• M. Gérard Raymond, président de France Assos Santé, Mme Claude Rambaud, vice-présidente, M. Jean-Pierre Thierry, conseiller médical, et M. Yann Mazens, conseiller Produits et technologies de la santé
14 heures : Les Entreprises du médicament (LEEM)
• Mme Claire Roger, présidente du comité Vaccins (Leem), directeur des opérations Vaccins (GSK)
• M. Thomas Borel, directeur Recherche, innovation, santé publique et Engagement sociétal (Leem)
• Mme Claire Desforges, responsable projets Santé publique (Leem)
• M. Laurent Gainza, directeur des Affaires publiques (Leem)
• Mme Elsa Biais-Sauvetre, responsable Affaires publiques et Veille stratégique (Pfizer)
• M. Anthony Goldgewicht, responsable Affaires gouvernementales (MSD Vaccins)
• Mme Telma Léry, directeur médical Infectiologie (Janssen Inc.)
• Mme Géraldine Ménin, directeur de Sanofi Pasteur France Market Access (Sanofi)
• M. Gabriel Thabut, directeur des affaires médicales, aire thérapeutique respiratoire (AstraZeneca)
15 heures : Delpharm
• M. Nicolas Ragot, directeur général délégué, chargé des opérations
• M. Stéphane Lepeu, directeur général délégué, chargé du commercial
16 heures : Association des maires de France
• M. Frédéric Chéreau, président de la commission Santé (maire de Douai)
• Mme Nelly Jacquemot, responsable du département Action sociale, éducation culture et santé
20 heures : Ministère des solidarités et de la santé - cabinet du ministre
• M. Clément Lacoin, directeur adjoint du cabinet
* (1) Les données moyennes sont, par tranche d'âge : 0,003 % pour les 0-4 ans, 0,001 % pour les 5-9 et 10-14 ans, 0,003 % pour les 15-19 ans, 0,006 % pour les 20-24 ans, 0,013 % pour les 25-29 ans, 0,024 % pour les 30-34 ans, 0,040 pour les 35-39 ans, 0,075 % pour les 40-44 ans, 0,121 % pour les 45-49 ans, 0,207 % pour les 50-54 ans, 0,323 % pour les 55-59 ans, 0,456 % pour les 60-64 ans, 1,08 % pour les 65-69 ans, 1,67 % pour les 70-74 ans, 3,20 % pour les 75-79 ans, et 8,29 % pour les plus de 80 ans. Les chiffres concernant la classe d'âges la plus élevée sont très variables d'un pays à l'autre (de 2,5 % à 15,5 %), ce qui peut en partie s'expliquer par le fait que les critères de déclaration diffèrent d'un pays à l'autre (prise en compte des décès hors structure hospitalière, etc.). Ces études mettent également en avant l'importance du sexe comme facteur de risque pour les populations âgées. En moyenne, le taux de létalité, chez les plus de 80 ans, est de 10,8 % pour les hommes et de 5,8 % pour les femmes. O'Driscoll, et al. « Age-Specific Mortality and Immunity Patterns of SARS-CoV-2 ». Nature, 2 novembre 2020, 1-6. https://doi.org/10.1038/s41586-020-2918-0 .
* 2 Présentation donnée par Alain Fischer dans le cadre de la deuxième séance exceptionnelle de l'Académie des sciences sur la Covid-19 ; https://www.youtube.com/watch?v=CaAcSJI0oMs&t=1424s
* 3 Dan, et al. « Immunological Memory to SARS-CoV-2 Assessed for Greater than Six Months after Infection ». BioRxiv, 16 novembre 2020, 2020.11.15.383323. https://doi.org/10.1101/2020.11.15.383323 .
* 4 Rydyznski Moderbacher, et al. « Antigen-Specific Adaptive Immunity to SARS-CoV-2 in Acute COVID-19 and Associations with Age and Disease Severity ». Cell 183, n o 4 (12 novembre 2020): 996-1012.e19. https://doi.org/10.1016/j.cell.2020.09.038 .
* 5 Van Dorp, et al. « No Evidence for Increased Transmissibility from Recurrent Mutations in SARS-CoV-2 ». Nature Communications 11, n o 1 (25 novembre 2020): 5986. https://doi.org/10.1038/s41467-020-19818-2 .
* 6 Polack, et al. « Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine ». New England Journal of Medicine (10 décembre 2020): null. https://doi.org/10.1056/NEJMoa2034577 .
* 7 « Moderna's COVID-19 Vaccine Candidate Meets Its Primary Efficacy Endpoint in the First Interim Analysis of the Phase 3 COVE Study | Moderna, Inc. » Consulté le 13 décembre 2020. https://investors.modernatx.com/news-releases/news-release-details/modernas-covid-19-vaccine-candidate-meets-its-primary-efficacy/ .
* 8 Voysey, et al. « Safety and Efficacy of the ChAdOx1 NCoV-19 Vaccine (AZD1222) against SARS-CoV-2: An Interim Analysis of Four Randomised Controlled Trials in Brazil, South Africa, and the UK ». The Lancet (8 décembre 2020). https://doi.org/10.1016/S0140-6736(20)32661-1 .
* 9 Vogel, et al. « A Prefusion SARS-CoV-2 Spike RNA Vaccine Is Highly Immunogenic and Prevents Lung Infection in Non-Human Primates ». BioRxiv, 8 septembre 2020, 2020.09.08.280818. https://doi.org/10.1101/2020.09.08.280818 et Corbett, et al. « Evaluation of the MRNA-1273 Vaccine against SARS-CoV-2 in Nonhuman Primates ». The New England Journal of Medicine 383, n o 16 (15 2020): 1544-55. https://doi.org/10.1056/NEJMoa2024671 .
* 10 Les effets secondaires les plus ressentis étaient la douleur au point d'injection, la fatigue et le mal de tête. 83 % des participants ont déclaré avoir ressenti de la douleur au point d'injection après la première injection chez les 16-55 ans, et 71 % chez les plus de 55 ans ; 59 % des 16-55 ans ont éprouvé de la fatigue après la seconde dose et 51 % des plus de 55 ans ; 52 % des 16-55 ans ont eu mal à la tête après la première injection (dont 2 % l'ont qualifié de sévère) et 39 % chez les plus de 55 ans. La plupart des effets déclarés se sont résolus en un ou deux jours. Polack, et al. « Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine ». New England Journal of Medicine (10 décembre 2020): null. https://doi.org/10.1056/NEJMoa2034577 .
* 11 https://www.has-sante.fr/
* 12 Articles L. 161-37 et suivants du code de la sécurité sociale.
* 13 Ainsi qu'un Conseil pour l'engagement des usagers (CEU) qui observe l'engagement des usagers en santé.
* 14 https://www.has-sante.fr/jcms/c_2755844/fr/commission-technique-des-vaccinations
* 15 https://www.has-sante.fr/jcms/p_3221343/fr/strategie-de-vaccination-contre-le-sars-cov-2
* 17 Article L. 5311-1 du code de la santé publique.
* 18 Régi par l'article L.1411-4 du code de la santé publique.
* 19 Régie par l'article L.1411-3 du code de la santé publique.
*
20
Source : Audition de Marie-Paule Kieny :
http://videos.assemblee-nationale.fr/video.10058107_5fd326903418e.opecst--mme-marie-paule-kieny-presidente-du-comite-scientifique-sur-les-vaccins-covid-19-11-decembre-2020
* 21 Source : Audition de M. Alain Fischer : http://videos.senat.fr/video.1885071_5fd1db846cba5.opecst--audition-publique----pr-alain-fischer-president-du-conseil-d-orientation-de-la-strategie-?timecode=2255116
* 22 https://www.santepubliquefrance.fr/
* 23 Articles L.1413-1 et suivants du code de la santé publique
*
24
Stratégie vaccinale contre la Covid-19 - Stratégie de
déploiement des vaccins disponibles. Note de cadrage de la Haute
Autorité de santé, 23 juillet 2020
https://www.has-sante.fr/upload/docs/application/pdf/2020-07/note_de_cadrage_strategie_vaccinale_contre_la_covid_19.pdf
* 25 Vaccins contre le SARS-CoV-2 - Une stratégie de vaccination. Note de cadrage des comités CARE, Comité scientifique COVID-19 et Comité Vaccin COVID-19, 9 juillet 2020 ; https://solidarites-sante.gouv.fr/IMG/pdf/avis_vaccins_9_juillet_2020_-_care_-_conseil_scientifique_-_comite_vaccin.pdf
* 26 Haute Autorité de Santé. « Stratégie de vaccination contre le Sars-Cov-2 - Recommandations préliminaires sur la stratégie de priorisation des populations à vacciner », 30 novembre 2020. https://www.has-sante.fr/jcms/p_3221338/fr/strategie-de-vaccination-contre-le-sars-cov-2-recommandations-preliminaires-sur-la-strategie-de-priorisation-des-populations-a-vacciner .
* 27 C'est le cas de l'Union régionale des médecins libéraux (URML) de Normandie, représentée par Antoine Leveneur lors d'une audition publique de l'Office.
* 28 Cette affirmation a été faite avant la publication des résultats scientifiques de phase 3 du vaccin Pfizer/BioNTech dans le New England Journal of Medicine.
* 29 Haute Autorité de Santé. « Stratégie de vaccination contre le Sars-Cov-2 - Recommandations préliminaires sur la stratégie de priorisation des populations à vacciner », 30 novembre 2020. https://www.has-sante.fr/jcms/p_3221338/fr/strategie-de-vaccination-contre-le-sars-cov-2-recommandations-preliminaires-sur-la-strategie-de-priorisation-des-populations-a-vacciner .
* 30 Vaccinations. (Articles L3111-1 à L3111-11) - Légifrance, Code de la santé publique §. Consulté le 10 décembre 2020. https://www.legifrance.gouv.fr/codes/section_lc/LEGITEXT000006072665/LEGISCTA000006171171/#LEGIARTI000036393260 .
* 31 Lequillerier, Clémentine. « La vaccination au prisme du droit pénal ». Revue de droit sanitaire et social RDSS , n o n° 5 (octobre 2018): pp.877-888.
* 32 ROCHEBLAVE, Avocat Spécialiste en Droit du Travail et Droit de la Sécurité Sociale | Eric. « Les employeurs pourront-ils obliger les salariés à se faire vacciner contre la COVID-19 ? » AVOCAT DROIT DU TRAVAIL | Avocat Montpellier | Avocat Spécialiste Droit du Travail | Eric ROCHEBLAVE (blog), 14 novembre 2020. https://www.rocheblave.com/salaries-vaccin-covid19/ .
* 33 Article L3111-1 du Code de la santé publique
* 34 https://eur-lex.europa.eu/legal-content/FR/TXT/PDF/?uri=CELEX:32020L0739&from=FR
* 35 https://www.legifrance.gouv.fr/codes/article_lc/LEGIARTI000018530428
* 36 Article L1152-1 - Code du travail, Code du Travail §. Consulté le 11 décembre 2020. https://www.legifrance.gouv.fr/codes/article_lc/LEGIARTI000006900818/2008-05-01 .
* 37 Sigalos, MacKenzie. « Yes, Your Boss Can Fire You If You Refuse to Get a Covid Vaccine ». CNBC, 7 décembre 2020. https://www.cnbc.com/2020/12/07/covid-vaccine-update-your-boss-can-fire-you-if-you-refuse-the-coronavirus-shot.html .
* 38 LCI. « Non, il n'est pas question de certificat de vaccination anti-covid », 21 novembre 2020. https://www.lci.fr/population/non-il-n-est-pas-question-de-certificat-de-vaccination-anti-covid-2170727.html .
* 39 France Bleu. « Coronavirus : bientôt un certificat électronique de vaccination en Europe ? », 3 décembre 2020. https://www.francebleu.fr/infos/sante-sciences/coronavirus-bientot-un-certificat-electronique-de-vaccination-1607010596 .
* 40 Déchets d'activités de soins à risques infectieux (DASRI).
*
41
Voir les
rapports du Sénat et de l'Assemblée nationale :
-
http://www.assemblee-nationale.fr/13/dossiers/enquete_campagne_vaccination_grippeA.asp
-
https://www.senat.fr/dossier-legislatif/ppr09-226.html
* 42 https://www.ecdc.europa.eu/sites/default/files/documents/Overview-of-EU_EEA-UK-vaccination-deployment-plans.pdf
* 43 https://www.bundesgesundheitsministerium.de/fileadmin/Dateien/3_Downloads/Gesetze_und_Verordnungen/GuV/B/3._BevSchG_BGBl.pdf
* 44 https://dip21.bundestag.de/dip21/btd/19/243/1924362.pdf
* 45 https://www.mscbs.gob.es/gabinetePrensa/notaPrensa/pdf/24.11241120144436287.pdf
* 46 L'« Alliance inclusive pour un vaccin » comprend la France, l'Allemagne, les Pays-Bas et l'Italie. Au niveau national, et de façon également inhabituelle, ces négociations ont été suivies par la ministre déléguée chargée de l'Industrie, Agnès Pannier-Runacher, et par le secrétaire d'État chargé des affaires européennes, Clément Beaune.
* 47 Plus tôt dans l'année, le remdesivir développé par le laboratoire Gilead (cf. infra) avait également bénéficié de cette procédure.
* 48 L'autre étant naturellement le secret des affaires, quoique la possibilité de communiquer sur les prix ait été prévues par les accords passés avec les États-Unis.
* 49 Contrairement à la Commission européenne, le Gouvernement américain a rendus publics à la fois le volume et le montant total des contrats, ce qui permet de déduire un prix unitaire. Pour rappel, les prix européens sont calculés soit à partir des prix américains, soit à partir des annonces individuelles des laboratoires, une part de la différence finale tenant à la composition des portefeuilles de vaccins.
* 50 Il ne donne pas lieu, en revanche, à une prise de participation au capital : cette garantie de « non-dilution », pour un investissement élevé et précoce, constitue un avantage supplémentaire pour l'entreprise.
* 51 Les Echos du 9 décembre 2020.
* 52 Il est encore trop tôt pour savoir si celui-ci sera atteint.
* 53 Parmi plus de 100 candidats potentiels identifiés. La BARDA a aussi investi, plus marginalement, dans d'autres traitements que les vaccins. La liste des 73 entreprises bénéficiant d'un financement de la BARDA au titre du Covid-19 est disponible ici : https://www.medicalcountermeasures.gov/app/barda/coronavirus/COVID19.aspx
* 54 Il s'agit notamment de revoir le rôle de l'ensemble des agences européennes concernées par les enjeux sanitaires (EMA, ECDC, ECHA, EFSA, EU-OSHA), ce qui annonce de difficiles négociations s'agissant de leur champ de compétence comme de leur budget.
* 55 Cour des comptes, « L'utilisation des fonds mobilisés pour la lutte contre la pandémie grippale A(H1N1)v », communication à la commission des affaires sociales du Sénat, septembre 2010.
* 56 Le vaccin contre la grippe A nécessitait lui aussi deux doses par personne.
* 57 Une telle décision relève des autorités sanitaires, et pas de la stratégie achats, mais elle n'est pas inconcevable. Par exemple, il pourrait être envisagé de réserver les vaccins les plus coûteux, s'ils sont plus efficaces, aux populations présentant des risques particuliers, notamment s'agissant des effets secondaires. Ou encore, de privilégier l'utilisation du vaccin AstraZeneca s'il se confirmait qu'une dose et demie est plus efficace que deux doses auprès de certaines populations (le sous-groupe concerné par l'erreur de protocole, où une dose et demie avait démontré une efficacité de 90 % contre 62 % pour le sous-groupe ayant reçu deux doses, était en moyenne plus jeune). Il s'agit là encore d'arguments difficilement audibles sur le plan politique, alors même qu'ils déterminent par ailleurs l'ordre de priorité fixé par la HAS.
* 58 En France, la HAS avait quant à elle émis le 17 septembre 2020 un avis favorable au remboursement du remdesivir, quoiqu'assorti de fortes réserves, et bien que la demande de remboursement déposée par Gilead eût déjà été retirée à cette date.
* 59 Voir à cet égard https://www.lemonde.fr/planete/article/2020/11/27/covid-19-comment-gilead-a-vendu-son-remdesivir-a-l-europe_6061300_3244.html
* 60 Il s'agit donc d'un prix théorique par personne « vaccinable », qui se comprend aussi comme un prix par contribuable.
* 61 On peut toutefois noter que ces délais ne permettront à l'usine Delpharm d'approvisionner la France lors des deux premières phases de la campagne vaccinale (EHPAD et personnes à risques), et que la troisième phase, durant laquelle les médecins traitants joueront un rôle essentiel, rend plus difficile l'utilisation de flacons multidoses conservés à -70°C.
* 62 Rapport d'information de Jean-Pierre Decool, fait au nom de la mission d'information sur la pénurie de médicaments et de vaccins, 27 septembre 2018. Votre rapporteure Sonia de la Provôté était membre de cette mission d'information.
* 63 Au-delà des tensions sur l'approvisionnement, cette dépendance stratégique pose régulièrement des problèmes de qualité des produits. On citera par exemple le cas de l'hérapine (anticoagulant) en 2008 ou du valsartan (hypertension), qui a fait l'objet d'un rappel mondial en 2018 à la suite d'une contamination à la nitrosamine. Voir à ce sujet : https://www.euractiv.fr/section/sante-modes-de-vie/news/la-dependance-suicidaire-de-leurope-aux-medicaments-made-in-china/
* 64 Droits de propriété intellectuelle et développement économique : perspective historique, OMPI, juin 2007, Pr. Zorina Khan
* 65 Patents and Cumulative Innovation, C. Long, janvier 2020, Washington University Journal of Law and Policy
* 66 « Compulsory licensing of efavirenz in Brazil in 2007: contextualization », W. Rodrigues, Rev Panam Salud Publica, 2009
* 67 « Campaigners warn that 9 out of 10 people in poor countries are set to miss out on COVID-19 vaccine next year », OXFAM, 9 décembre 2020
* 68 https://peoplesvaccine.org/
* 69 India, South Africa ask WTO to ease IP rules for COVID-19, AP, N. Ghosal et C. Annas, 3 octobre 2020.
* 70 Global equitable access to COVID-19 vaccines estimated to generate economic benefits of at least US$ 153 billion in 2020-21, and US$ 466 billion by 2025, in 10 major economies, according to new report by the Eurasia Group., OMS, 3 décembre 2020.
* 71 Commission européenne “L'UE porte sa contribution au mécanisme COVAX à 500 millions d'euros pour garantir aux pays à revenu faible ou intermédiaire l'accès aux vaccins contre la COVID-19", 12 novembre 2020
* 72 Did China Join COVAX to Counter or Promote Vaccine Nationalism? The Diplomat, Hemant Adlakha 23 octobre 2020
* 73 Over US$ 2 billion raised to support equitable access to COVID vaccines with additional US$ 5 billion needed in 2021, OMS, 13 novembre 2020
* 74 UN News, Fund COVAX to reduce COVID vaccination distribution inequity - UN chief
* 75 Science, Development of unique Australian COVID-19 vaccine halted, Dennis Normile, 11 décembre 2020
* 76 Mapping covid-19 vaccine pre-purchases across the globe, The Launch and Scale Speedometer, Duke Global Health Innovation Center : https://launchandscalefaster.org/COVID-19
* 77 Françoise Salvadori et Laurent-Henri Vignaud, Antivax : la résistance aux vaccins du XVIII e siècle à nos jours, Paris, Vendémiaire, 2019.
* 78 En 2017, pour mémoire, une étude de l'Ifop pour la Fondation Jean Jaurès et le site Conspiracy Watch montrait que les Français croiraient pour 55 % d'entre eux que « le ministère de la Santé est de mèche avec l'industrie pharmaceutique pour cacher au grand public la réalité sur la nocivité des vaccins ». Ce chiffre est tombé à 43 % en 2018 puis à 33 % en 2020. Cf. en ligne
* 79 Cf. Alain Cambier, « Le complotisme est un mal endémique en temps de pandémie », Le Monde, 19 avril 2020, en ligne .
* 80 Il s'agit d'un fameux « effet Treisand », bien connu en sciences sociales, selon lequel les démystificateurs, en souhaitant prouver l'invalidité d'une fausse information, démultiplient en réalité sa diffusion. Cf. par exemple Alexandra Saviana, « Obsession du “fact-checking” : et si les médias combattaient mal les fake news... », Marianne, 6 février 2019, en ligne ; Manon Berriche, « Le fact-checking est-il vraiment efficace ? », Sciences Po, 22 janvier 2020, e n ligne .
* 81 Cf. la note scientifique n°17 « La politique vaccinale en France », présentée par M. Cédric Villani, député, Président de l'Office, M. Jean-François Eliaou, député, et Mme Florence Lassarade, sénatrice, en ligne .
* 82 Cf. le rapport de l'OPECST « L'hésitation vaccinale », suite à l'audition publique du 14 novembre 2019 en ligne .
* 83 Cf. les travaux du sociologue Jeremy Ward ou l'article d'Ève Dubé et Noni E. MacDonald, « How can a global pandemic affect vaccine hesitancy? », Expert Review of Vaccines, vol. 18, n° 10, 2020, en ligne .
* 84 Coralie Chevallier, Anne-Sophie Hacquin et Hugo Mercier, « Trois recommandations d'actions pour lutter contre l'hésitation vaccinale », contribution pour « Coronavirus : regards sur une crise », Terra Nova, 4 décembre 2020, en ligne.
* 85 Jeremy K. Ward et Patrick Peretti-Watel, « Comprendre la méfiance vis-à-vis des vaccins : des biais de perception aux controverses », Revue française de sociologie, vol. 61, n° 2, 2020, pages 243 à 273, en ligne .
* 86 Selon le sondage publié par Odoxa le 12 novembre, 34% des 25-34 ans consentiraient à se faire vacciner, contre 58% des plus de 50 ans.
* 87 L'hésitation vaccinale est définie comme « Un retard dans l'acceptation ou le refus des vaccins malgré la disponibilité de services de vaccination. Un phénomène complexe, spécifique au contexte et qui varie selon le moment, le lieu et les vaccins. Il inclut certains facteurs comme la sous-estimation du danger, la commodité et la confiance. » par le groupe SAGE réuni par l'OMS, 2015, cf. en ligne .
* ARTICLE I. 88 Cf. Jocelyn Raude, « Vaccination : une hésitation française », The Conversation, 2 décembre 2020, en ligne ; cf. aussi Jeremy K. Ward, « Rethinking the antivaccine movement concept : A case study of public criticism of the swine flu vaccine's safety in France », Social Science and Medecine, vol. 159, juin 2016, pages 48 à 57, en ligne .
* 89 OMS, « Ten threats to global health in 2019 », janvier 2019, en ligne .
* 90 Ipsos, « Global attitudes on a Covid-19 vaccine », Sondage Ipsos pour le Forum économique mondial, octobre 2020, en ligne .
* 91 Ipsos/Sopra Steria pour Le Monde, la Fondation Jean Jaurès et l'Institut Montaigne, « Fractures françaises 2020 », vague 8, septembre 2020, en ligne .
* 92 Cf. https://www.lejdd.fr/Politique/sondage-covid-19-59-des-francais-nont-pas-lintention-de-se-faire-vacciner-4008724
* 93 Emmanuel Hirsch (sous la dir.), Pandémie 2020, éthique, société, politique, Paris, éditions du Cerf, 2020.
* 94 Henri Bergeron, Olivier Borraz, Patrick Castel et François Dedieu, Covid-19 : une crise organisationnelle, Paris, Presses de Sciences Po, « Essai », 2020.
* 95 « Covid-19 : politicization, “corruption,” and suppression of science : when good science is suppressed by the medical-political complex, people die », British Medical Journal, 371, 13 novembre 2020. Cf. https://www.bmj.com/content/371/bmj.m4425
* 96 Odaxa avec Dentsu Consulting pour Le Figaro et France Info, « Lutte contre le covid-19 et port du masque », avril 2020, en ligne .
* 97 Ifop, « Les Français et le COVID-19: confiance dans le gouvernement et intention de se faire vacciner », sondage pour le Journal du Dimanche, novembre 2020, en ligne .
* 98 Le Conseil scientifique et la multiplication des comités -dans une logique de polysynodie - ont pu accroître cette perception de cénacles secrets entourant l'action du gouvernement. Le recours croissant au Conseil de Défense a également contribué à ce sentiment.
* 99 Ipsos/Sopra Steria pour Le Monde, la Fondation Jean Jaurès et l'Institut Montaigne, « Fractures françaises 2020 », vague 8, septembre 2020, en ligne .
* 100 Jeremy K. Ward, Caroline Alleaume, Patrick Peretti-Watel, Groupe Coconel, « The French public's attitudes to a future COVID-19 vaccine: The politicization of a public health issue », Social Science & Medicine, vol. 265, novembre 2020, en ligne .
* 101 Yann Thompson, « Vaccins : pourquoi sommes-nous si méfiants ? », Francetvinfo, 10 décembre 2020, en ligne .
* 102 Clarisse Martin, « Pourquoi la population française est-elle si hostile vis-à-vis des vaccins ? », BFMTV, 10 novembre 2020, en ligne .
* 103 Odoxa avec Dentsu Consulting pour Le Figaro et France Info, « Regard des Français sur le vaccin contre le Covid-19 », novembre 2020, en ligne .
* 104 Jonathan Kennedy, « Populist politics and vaccine hesitancy in Western Europe: an analysis of national-level data », European Journal of Public Health, vol. 29, n° 3, join 2019, pages 512 à 516, en ligne .
* 105 Pierre Verger et Patrick Peretti-Watel, « L'hésitation vaccinale : une revue critique », Journal des Anti-infectieux, vol. 17, n° 3, octobre 2015, pages 120 à 124, en ligne .
* 106 Ipsos, « Baromètre Science et société », vague 1, baromètre réalisé pour l'Institut Sapiens, octobre 2020, en ligne .
* 107 Ipsos, « Les attitudes des Français à l'égard de la science », sondage réalisé pour la fondation Nicolas Hulot.
* 108 Cf. https://www.ccne-ethique.fr/sites/default/files/publications/reponse_ccne_-_covid-19_def.pdf
* 109 Ipsos, « Global attitudes on a Covid-19 vaccine », Sondage Ipsos pour le Forum économique mondial, octobre 2020, en ligne .
* 110 Ipsos, « Global attitudes on a Covid-19 Vaccine », Sondage Ipsos pour le Forum économique mondial, juillet-août 2020, en ligne .
* 111 Un article de J.Ward va dans ce sens « Informer sans inquiéter: rationalité et irrationalité du public dans la communication sur la grippe A », in: Les publics de l'action publique: gouvernement et résistances, Presses du Septentrion, Villeneuve-d'Ascq, 2016. Et voici un exemple de travaux du groupe Coconel sur ce sujet : https://www.thelancet.com/journals/laninf/article/PIIS1473-3099(20)30426-6/fulltext
* 112 Le problème repose alors sur l'intrication entre, d'une part, l'évaluation de la valeur de vérité des informations diffusées et, d'autre part, le degré de liberté d'expression laissé aux propagateurs relativement aux conséquences de leurs actes de parole. Cette complexité de l'évaluation éthique est en outre aggravée par le fait que, sur les réseaux sociaux, tout individu ou tout groupe constitué rapidement ou spontanément (souvent uniquement en ligne) peut diffuser ses opinions à une échelle globale. Cette absence de sélection et la remise à plat des hiérarchies sociales est un facteur de premier plan dans l'analyse éthique. La situation créée par la crise Covid-19 a davantage participé à cette relativisation informationnelle : tout d'abord, le confinement a produit l'isolement des individus et les a rendus plus dépendants des réseaux numériques ; ensuite, la science, dont la temporalité est toujours plus lente que celle de l'actualité, a dû intégrer des facteurs d'incertitude radicale dans une communication sur des enjeux vitaux pour l'ensemble de la population. Un article met ainsi l'accent sur le rôle qu'ont pu jouer et que pourront jouer les réseaux sociaux dans la confiance et lutte contre la défiance vaccinale : https://www.nature.com/articles/s41586-020-2281-1
* 113 Pierre Verger et Ève Dubé, « Restoring confidence in vaccines in the COVID-19 era », Expert Review of Vaccines, octobre 2020, en ligne .
* 114 Emmanuel Laurentin, « Le Covid peut-il changer le rapport des Français aux vaccins ? », en présence d'Alain Fischer, Lucie Guimier et Elisabeth Bouvet, Le Temps des débats, France Culture, 12 novembre 2020, 39 minutes, en ligne .
* 115 Pierre Verger, « Les médecins face à la crise de confiance dans la vaccination en France », Médecine, vol. 13, n° 3, mars 2017, pages 110 à 114, en ligne : « Ces résultats indiquent que les multiples controverses vaccinales en France ont contribué à développer une hésitation vaccinale chez les médecins généralistes et que cette hésitation dépend en partie de la confiance relative qu'ils accordent aux autorités de santé. »
* 116 Cf. https://solidarites-sante.gouv.fr/IMG/pdf/avis_vaccins_9_juillet_2020_-_care_-_conseil_scientifique_-_comite_vaccin.pdf
* 117 Surtout qu'un certain oubli historique frappe la vaccination, à mesure que les maladies reculent et que leur spectre s'efface de la conscience collective. Cette forme d'invisibilisation de la maladie rend, à l'inverse, sur-visible les risques de la vaccination, quand surviennent des effets secondaires.
* 118 Ross Upshur, « Principles for the Justification of Public Health Intervention », Canadian Journal of Public Health, vol. 93, n° 2, p. 101-103, 2002, http://www.jcb.utoronto.ca/people/publications/cjph2002.pdf
* 119 Centre de collaboration nationale sur les politiques publiques et la santé, « Éthique en santé publique -- ressources sélectionnées : éthique et pandémie », mai 2010, https://www.ccnpps.ca/docs/EthiquePandemieRevueLitterature_Fr.pdf
* 120 CCNE, « Contribution du Comité consultatif national d'éthique : Enjeux éthiques face à une pandémie », 13 mars 2020, https://www.ccne-ethique.fr/sites/default/files/publications/reponse_ccne_-_covid-19_def.pdf
* 121 CARE -- comité scientifique covid-19 -- comité vaccin covid-19, « Vaccins contre le SARS-CoV-2 : une stratégie de vaccination », 9 juillet 2020, http://www.erebfc.fr/ressource/avis_vaccins_9_juillet_2020_-_care_-_conseil_scientifique_-_comite_vaccin.pdf?id=257
* 122 Académie nationale de pharmacie, « La vaccination : un enjeu éthique pour les pharmaciens », 25 février 2020, https://www.acadpharm.org/dos_public/2020_02_25_VACCINATION_ETHIQUE_PHARMACIENS.PDF
* 123 Coralie Chevallier, « Utiliser la recherche en psychologie pour lutter contre la défiance vis-à-vis de la vaccination », Slate, 19 mars 2017, http://www.slate.fr/story/139565/recherche-en-psychologie-lutter-contre-la-defiance
* ARTICLE II. 124 Ouest France et AFP, « Vaccins. Les Ehpad veulent des directives sur le consentement des seniors souffrant d'Alzheimer », Ouest France, 8 décembre 2020, https://www.ouest-france.fr/sante/vaccin/vaccins-les-ehpad-veulent-des-directives-sur-le-consentement-des-seniors-souffrant-d-alzheimer-7077869
* 125 OMS, « Document conceptuel de l'OMS à l'appui d'un accès juste aux produits sanitaires liés à la COVID-19 et de leur allocation équitable », 2020, https://www.who.int/docs/default-source/coronaviruse/allocation-of-covax-vaccines-explainer-french.pdf
* 126 Matteo Chinazzi, Jessica T. Davis, Natalie E. Dean, Kunpeng Mu, Ana Pastore y Piontti, Xinyue Xiong, M. Elizabeth Halloran, Ira M. Longini Jr., Alessandro Vespignani, « Estimating the effect of cooperative versusuncooperative strategies of COVID-19vaccine allocation: a modeling study », 2020, https://www.mobs-lab.org/uploads/6/7/8/7/6787877/global_vax.pdf
* ARTICLE III. 127 Caroline Coq-Chodorge, « Lucie Guimier: “À travers le mouvement anti-vaccins s'exprime une défiance envers l'État”, Mediapart, 27 novembre 2020, https://www.mediapart.fr/journal/france/271120/lucie-guimier-travers-le-mouvement-anti-vaccins-s-exprime-une-defiance-envers-l-etat?onglet=full
* 128 Cf. https://solidarites-sante.gouv.fr/IMG/pdf/avis_cns2_150420_cp_revu_er_env_2206_250620_espace.pdf
* 129 Cf. https://www.20minutes.fr/sante/2929431-20201211-coronavirus-quoi-va-donc-servir-collectif-citoyen-vaccins-alors-strategie-deja-bouclee
* 130 Pour mémoire : Recommandation n°1. L'acceptabilité sociale de la vaccination, et notamment son organisation, doivent être discutées avec des groupes représentatifs des populations concernées, leurs parties prenantes ou par voie de consultation publique. Recommandation n°2. Quand des populations prioritaires sont définies, les critères de priorisation doivent être justifiés scientifiquement et sur la base de fondements éthiques, et reposants sur une démonstration compréhensible pour tous. Recommandation n°3. La communication publique doit absolument reposer sur une présentation du bénéfice pour la personne concernée, et du bénéfice collectif pour ses proches et l'ensemble de la société. Recommandation n°4. La communication auprès du grand public doit être effectuée dans un langage adapté au plus grand nombre, d'une part, et aux cibles spécifiques, d'autre part, en s'appuyant alors sur les associations concernées. Recommandation n°5. L'organisation de la vaccination doit permettre l'accès du plus grand nombre sans omettre de recours aux stratégies d'aller-vers, pour la rapprocher des bénéficiaires potentiels en recourant autant que de besoin aux structures en capacité de conduire ces démarches, y compris les approches en santé communautaire. Recommandation n°6. Pour la pleine effectivité de la vaccination et de sa sécurité, sa traçabilité justifie le recours à des outils numériques dans le respect des règles protégeant la vie privée. Recommandation n°7. La transparence sur la vaccination doit porter sur la justification scientifique des vaccins destinés aux groupes-cibles, les effets secondaires et les effets indésirables dont la notification par tous doit être encouragée, ainsi que sur l'état des stocks disponibles.
* 131 Cf. l'article de Jean-Louis Montastruc et al., « Which pharmacovigilance for vaccines ? », Bulletin de l'Académie Nationale de Médecine, 2016, n° 200, pages 241-250. C'est d'autant plus important les effets indésirables consécutifs à l'injection d'un vaccin n'étant rapportés que faiblement, le dispositif de surveillance, qui repose sur les déclarations des médecins et des patients, doit être renforcé pour détecter tout effet indésirable. La non-déclaration des effets indésirables consécutifs à la prise d'un produit de santé serait de l'ordre de 80 à 95 %, cf. Hazelland Shakir, « Under-Reporting of Adverse Drug Reactions », 2006, Drug-Safety, n° 29, pages 385-396.