B. MIEUX HIÉRARCHISER LES RISQUES DE RUPTURE
1. Assurer l'exhaustivité et la publicité de la liste des médicaments d'intérêt thérapeutique majeur (MITM)
· Introduite par la loi « santé » de 2016205(*), la catégorie des MITM rassemble l'ensemble des médicaments pour lesquels une interruption de traitement est susceptible de mettre en jeu le pronostic vital des patients à court ou moyen terme, ou représente une perte de chance importante pour les patients au regard de la gravité ou du potentiel évolutif de la maladie.
Particulièrement large - elle regroupe environ 6 000 médicaments, soit près de la moitié des spécialités commercialisées -, la catégorie n'en présente pas moins l'utilité d'imposer un socle d'obligations renforcées aux exploitants pour des médicaments dont l'intérêt thérapeutique est avéré.
Décrites en première partie de ce rapport, celles-ci comprennent notamment :
- l'obligation d'élaborer un plan de gestion des pénuries (PGP)206(*) ;
- celle d'informer immédiatement l'ANSM en cas de rupture ou de risque de rupture et de prendre, dans ce cas, les mesures d'accompagnement et d'information appropriées207(*) ;
- l'obligation de constituer un stock de sécurité devant couvrir au moins deux mois de besoins, contre une semaine pour les médicaments n'étant pas des MITM208(*).
· Si la pertinence de la catégorie a été soulignée par de nombreuses personnes auditionnées, plusieurs d'entre elles ont toutefois dénoncé l'opacité entourant son contenu. La présidente du Conseil national de l'ordre des pharmaciens a ainsi signalé, en audition, que si la liste « n'est pas connue des dispensateurs, il serait utile qu'elle le soit »209(*).
En effet, si les classes thérapeutiques susceptibles de contenir des MITM sont connues, puisqu'elles figurent en annexe d'un arrêté de 2016210(*), la liste des MITM identifiés par les industriels n'est, elle, pas publiée. Cela est d'autant plus surprenant que l'ANSM ne peut ignorer cette information depuis que la LFSS pour 2020 et le décret de mars 2021 ont contraint les industriels à lui transmettre, chaque année et pour chacun des MITM qu'ils commercialisent211(*), un PGP.
Plusieurs rapports ont déjà invité l'ANSM à systématiser la recension des PGP reçus et à rendre publique la liste des MITM qui en résulte :
- le rapport de l'IGAS et du CGE de 2021 encourageait ainsi l'ANSM à « se doter d'un gestionnaire de base de données pour les médicaments », cette base devant comporter « au moins un champ “PGP : Oui/Non” »212(*) ;
- le rapport de M. Jacques Biot relatif aux pénuries de médicaments, remis au Premier ministre en juin 2020, suggérait d'« instaurer un principe d'open data sur le contenu de la liste des MITM, l'établissement de cette liste demeurant de la responsabilité des exploitants »213(*).
La commission d'enquête souscrit à ces propositions et appelle l'ANSM à faire oeuvre de transparence en rendant publique la liste des MITM identifiés par les exploitants.
· L'identification des MITM relevant de la responsabilité des entreprises, l'exhaustivité de la liste est également régulièrement interrogée.
La DGS relève ainsi que « les associations de patients et les prescripteurs ont plutôt une approche critique sur l'insuffisante couverture des MITM dans certains cas, et demandent régulièrement la requalification de médicaments en MITM »214(*). Ce serait le cas, par exemple, du paracétamol pédiatrique.
Pour les mêmes raisons, certains médicaments produits par plusieurs exploitants peuvent recevoir un traitement contradictoire et, en conséquence, faire l'objet d'obligations inégales. Le directeur général et pharmacien responsable du laboratoire Delbert a ainsi révélé, lors de son audition : « L'une de nos spécialités, l'amoxiclave, dont nous avons le princeps, qu'on appelait auparavant l'Augmentin, comporte tous les dosages. Nous avons déclaré toutes ces présentations comme MITM. Notre confrère et néanmoins ami génériqueur n'a pas fait le même choix. Un seul de ses dosages est déclaré comme MITM. Il n'a donc pas les mêmes contraintes en termes de stocks - nous devons avoir quatre mois de stocks pour chaque présentation. Ceci nécessitait une harmonisation, car il est difficile d'avoir deux traitements différents pour un même médicament. »215(*)
Cette inégalité apparaît d'autant plus surprenante lorsque, comme dans le cas d'espèce, le médicament en question fait partie des MITM pour lesquels l'ANSM a jugé le risque de rupture suffisamment récurrent pour justifier l'instauration de stocks de sécurité renforcés.
Dans ces circonstances et compte tenu de l'inégale application des critères légaux par les industriels, l'ANSM doit pouvoir inclure des médicaments dans la catégorie des MITM ou, au contraire, en exclure des médicaments considérés à tort par leur exploitant comme relevant de cette catégorie. L'ANSM doit également procéder à une revue de la liste des MITM en veillant à ce que le traitement des spécialités commercialisées par plusieurs entreprises demeure équitable. Une fois ainsi établie, la liste des MITM devra être publiée sur le site de l'agence.
Recommandation n° 4 : Rendre publique la liste des MITM et permettre à l'ANSM d'y inclure ou d'en exclure des spécialités.
2. Identifier les médicaments concentrant les risques thérapeutiques et industriels les plus importants
a) L'idée ancienne d'une liste restreinte de spécialités critiques
La catégorie des MITM, particulièrement large, apparaît utile pour imposer aux industriels un socle commun d'obligations nécessaires dans le cas de médicaments d'intérêt thérapeutique important. Elle ne permet toutefois pas de prioriser les efforts visant à sécuriser l'accès et l'approvisionnement sur les spécialités les plus indispensables à la prise en charge des patientes et des patients.
Dans cet objectif de sécurisation, l'établissement d'une liste de quelques centaines de spécialités essentielles apparaît indispensable. L'idée est ancienne et a déjà fait l'objet de plusieurs tentatives de mise en oeuvre.
· L'Organisation mondiale de la santé (OMS), d'abord, publie depuis 1977 une liste modèle de médicaments essentiels, rassemblant les spécialités qui répondent aux besoins de santé prioritaires d'une population. Ces médicaments sont ceux, selon l'Organisation, qui « doivent être disponibles en permanence dans un système de santé qui fonctionne bien, sous une forme galénique appropriée, avec une qualité garantie et à un prix abordable au niveau individuel comme pour la communauté. » Depuis 2020, la liste est disponible en libre accès et sous format numérique sur le site internet de l'OMS216(*).
La liste modèle est révisée, depuis son établissement, tous les deux ans. La dernière révision est intervenue en 2021 et a fait l'objet d'une publication au mois d'octobre : elle porte à 479 le nombre de médicaments essentiels identifiés, couvrant l'ensemble des quatorze groupes généraux de la classification ATC217(*).
· Comme l'OMS le recommande, des listes nationales ont par ailleurs été établies dans certains pays.
Aux États-Unis, un Executive order du 6 août 2020 a enjoint à la Food and drug administration (FDA) de préparer, sous quatre-vingt-dix jours, une liste de médicaments, contre-mesures médicales et intrants essentiels dont il est « médicalement nécessaire de disposer à tout moment en quantité suffisante pour répondre aux besoins des patients, dans les formes posologiques appropriées »218(*). En application de cet acte, la FDA a établi en octobre 2020 une première liste de produits essentiels comprenant 226 médicaments et 98 dispositifs médicaux.
D'autres pays ont défini des listes nationales de produits essentiels, plus ou moins éloignées de celle établie, en modèle, par l'OMS219(*).
· En France, l'idée de l'identification d'une liste de médicaments essentiels ou critiques a été évoquée à de nombreuses reprises.
La mission d'information sénatoriale sur les pénuries de médicaments et de vaccins recommandait ainsi déjà, en 2018, pour « cibler les mesures incitatives à mettre en place afin d'encourager la relocalisation des capacités de production en Europe et l'établissement de stocks de sécurité sur des produits déterminés », de définir au niveau européen une « liste de médicaments et substances pharmaceutiques actives stratégiques pour la sécurité sanitaire européenne »220(*).
Depuis la même année, l'Institut national du cancer (INCa) et les Entreprises du médicament (Leem) ont, par ailleurs, piloté une mesure du Conseil stratégique des produits de santé (Csis) visant à sécuriser l'approvisionnement en anticancéreux anciens à risque fort de pénurie. Cette initiative a permis l'établissement d'une liste de 43 médicaments anticancéreux jugés indispensables à la prise en charge des patientes et des patients. Elle avait été prolongée par la feuille de route 2019-2022 relative aux pénuries de médicaments, qui visait à « développer des solutions visant à sécuriser » les spécialités identifiées221(*).
Enfin, le rapport précité de l'Igas et du CGE, réalisé à l'initiative du Haut-commissariat au Plan et relatif aux vulnérabilités d'approvisionnement en produits de santé, suggérait en 2021, « si l'on souhaite adopter des mesures encore plus fortes en termes de sécurisation des approvisionnements dans le cadre national, de se concentrer sur les produits les plus sensibles, au sens de l'impact de leur pénurie potentielle sur la santé des patients et de la probabilité d'occurrence de telles pénuries »222(*).
Dans cet objectif, le rapport proposait une méthodologie d'identification des médicaments et dispositifs médicaux critiques d'un point de vue sanitaire comme industriel et la menait à son terme pour deux aires thérapeutiques : la cardiologie et l'anesthésie-réanimation. Il invitait le Gouvernement à généraliser l'identification des médicaments critiques, à horizon 2022.
b) La liste des médicaments essentiels publiée par le ministère de la santé et de la prévention en juin 2023
Le ministre de la santé et de la prévention et le ministre de l'Industrie ont annoncé en février 2023, en réaction aux pénuries constatées durant la saison hivernale, l'établissement, d'ici la fin du mois de mai de la même année, d'une « liste des médicaments dits “critiques” car stratégiques pour la santé de nos concitoyens [...] sur la base des recommandations des autorités scientifiques ». Les ministres précisaient qu'à « cette liste [seraient] attachées une analyse des risques en matière d'approvisionnement, et des solutions correctrices nécessaires ».
La commission d'enquête constate que ce calendrier, déjà tardif au regard de celui proposé par le rapport de l'IGAS et du CGE de 2021, n'a pas été tenu. À la date de finalisation de ses travaux, une liste de médicaments dits « essentiels » vient toutefois d'être publiée par le Gouvernement, qui ne comprend ni analyse des risques industriels associés à chacune des spécialités, ni solutions correctrices.
Méthodologie et contenu de la liste publiée
La liste des médicaments essentiels a été présentée le 12 juin 2023 par le ministre de la santé et de la prévention et publiée le lendemain. Le communiqué accompagnant la publication indique que « fondée sur la base de la pratique clinique des médecins français, sur la criticité du besoin et le caractère d'urgence de la spécialité médicale (infectiologie, endocrinologie, anesthésie-réanimation...), elle regroupe près de 450 médicaments. Enfin, les médicaments sélectionnés l'ont été dans l'objectif de proposer une médecine de haute qualité, pour chaque grand organe (coeur, rein, cerveau...). »223(*)
1. Méthodologie d'établissement de la liste
La liste a été établie dans chaque spécialité, selon un processus itératif suivant la « méthode Delphi », par un comité de pilotage (CP) et un groupe d'experts (CE) désignés par les sociétés savantes.
Sur la base d'une liste complète de substances actives fournie par la Société française de pharmacie clinique (SFPC), les CP ont établi une cotation de criticité a priori pour chacun des médicaments, selon deux critères :
- la fréquence d'utilisation (de 1 pour « rare, moins d'une fois par semaine » à 4 pour « très fréquent, plusieurs fois par jour ») ;
- la gravité d'une rupture médicamenteuse (de 1 pour « faible » à 4 pour « vitale : absence d'alternative, mise en jeu du pronostic vital si absent »).
Les CE ont évalué les propositions des CP
sur une échelle de 1 à 9
(de 1 pour « pas
du tout d'accord » à 9 pour « tout
à fait d'accord »).
Si plus de 90 % des membres du CE n'ont pas attribué une note de 7 à 9 pour une substance active, la cotation n'est pas adoptée. Elle est alors soumise à nouveau au CP, accompagnée des commentaires du CE.
La criticité est obtenue en multipliant la fréquence par la gravité et s'établit sur une échelle de 1 (utilisation rare et gravité faible) à 16 (utilisation très fréquente et gravité vitale). La criticité est jugée importante de 8 à 11, majeure à partir de 12.
2. Le contenu de la liste
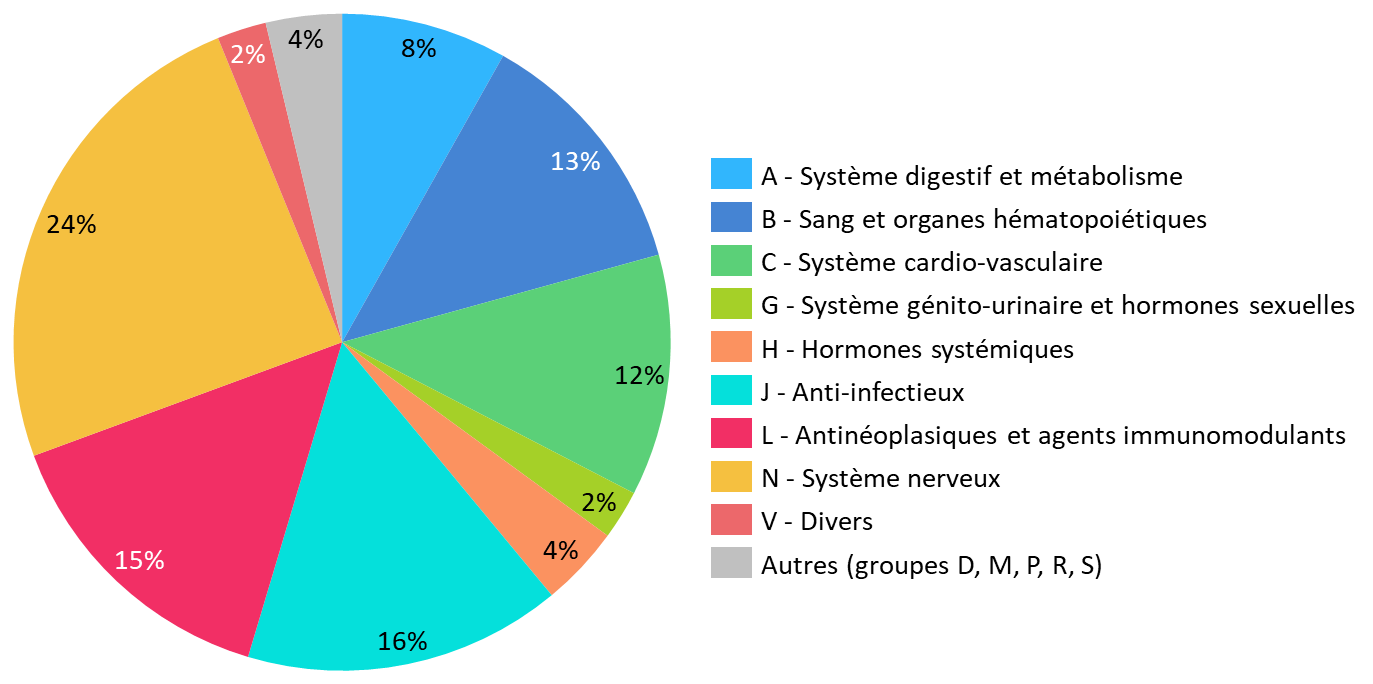
La liste publiée le 13 juin 2023 comprend 454 médicaments essentiels. Les quatorze groupes homogènes de la classification ATC sont couverts, bien que très inégalement :
- un seul médicament du groupe « D - Dermatologie » est listé : il s'agit de l'éthanol 96 %, classé parmi les antiseptiques et désinfectants ;
- à l'inverse, les médicaments du système nerveux, les antiinfectieux, les antinéoplasiques et agents immunomodulants rassemblent, à eux seuls, 249 médicaments essentiels, soit 55 % des substances actives identifiées.
Ces trois derniers groupes sont, d'après les données de l'ANSM, particulièrement touchés par les ruptures et risques de rupture de stock.
Toutefois, les médicaments du système cardio-vasculaire, qui ont concentré en 2022 29 % des ruptures ou risques de rupture déclarés, ne représentent que 12 % des médicaments essentiels listés.
Figurent, enfin, dans cette liste le paracétamol et l'amoxicilline, qui ont concentré de nombreuses difficultés d'approvisionnement lors de l'hiver 2022-2023.
Répartition des 454 médicaments essentiels par groupes principaux ATC
Source : Commission d'enquête, d'après la liste des médicaments essentiels publiée (version 12/06/23)
Enfin et au-delà des 454 substances actives listées, le Gouvernement inclut parmi les médicaments essentiels certaines spécialités associées aux plans de santé publique qu'il déploie :
- la lutte contre les addictions (traitements de substitution nicotinique, traitements de l'addiction aux opioïdes ou aux opiacés) ;
- la santé sexuelle (mifépristone et misoprostol pour une interruption de grossesse médicamenteuse ; lévonorgestrel pour la contraception d'urgence) ;
- la vaccination obligatoire ou relevant de recommandations (44 références commercialisées en France sont concernées).
Source : Commission d'enquête
· Si l'identification, en collaboration avec les sociétés savantes, de cette liste de substances actives essentielles, est une bonne chose, elle appelle toutefois trois points de vigilance.
D'abord, la liste contient d'ores et déjà 454 substances actives, chacune susceptible d'être commercialisées par de multiples entreprises sous de multiples formes galéniques, ainsi qu'une liste de plusieurs dizaines de médicaments associés aux plans de santé publique. Il conviendra de veiller à ce que la taille de la liste et le nombre de spécialités couvertes demeurent compatibles avec l'objectif initial de concentration des efforts sur un nombre restreint de médicaments.
En outre, cette liste devra faire l'objet d'une mise à jour régulière, en lien étroit avec les sociétés savantes et l'ANSM.
Enfin, les conditions d'établissement et de révision de la liste doivent faire l'objet d'une transparence renforcée224(*). La méthodologie suivie, les données exploitées, la liste des sociétés savantes et des personnes impliquées, leurs liens d'intérêt avec les entreprises pharmaceutiques constituent autant d'informations essentielles devant être publiées.
c) Garantir l'approvisionnement des médicaments essentiels identifiés
Si la liste des médicaments essentiels est désormais établie, elle ne trouvera son intérêt que dans les mesures spécifiques de surveillance, d'anticipation et de gestion des pénuries qui lui seront associées. À cet égard, le Gouvernement doit mettre en oeuvre sans plus tarder les mesures renforcées qu'il avait initialement annoncées pour le mois de mai.
· En matière de surveillance de l'approvisionnement et d'anticipation des pénuries, les médicaments essentiels identifiés par les sociétés savantes devront faire l'objet d'un suivi renforcé comprenant :
- une analyse avancée des capacités d'approvisionnement, des pratiques de prescription comme des tendances de consommation ;
- une cartographie fine des chaînes de production, facilitée par les états des lieux transmis annuellement par les entreprises pharmaceutiques à l'ANSM ;
- un contrôle effectif de l'état des stocks de sécurité constitués par les exploitants, comme de ceux situés, en aval, au sein du circuit de distribution (grossistes-répartiteurs, pharmaciens) ;
- un niveau d'exigence et de contrôle renforcé sur les PGP produits par les industriels, en amont de l'apparition d'une rupture ou d'un risque de rupture ;
- la recherche d'une meilleure réactivité et d'une détection rapide des signaux faibles de pénurie, en développant l'analyse des données de ventes et des données épidémiologiques pertinentes remontées à l'ANSM.
· Les médicaments essentiels listés devront également, en cas de pénurie, faire l'objet de mesures de gestion adaptées à leur criticité.
La mise en oeuvre de solutions de production de secours, pouvant tenir à des préparations officinales ou hospitalières, devra être favorisée.
· Enfin, ces médicaments pourraient faire l'objet de mesures spécifiques destinées à lutter structurellement contre les causes des tensions d'approvisionnement constatées.
Afin de lutter contre la fragmentation et la fragilisation des chaînes d'approvisionnement, et pour renforcer la souveraineté de la France sur ces produits essentiels, la relocalisation de tout ou partie de la production des médicaments essentiels présentant les plus forts risques de rupture devra, d'abord, être favorisée.
Sur ce point, si la commission d'enquête accueille favorablement les annonces du Président de la République concernant la relocalisation de la fabrication d'une cinquantaine de médicaments, dont vingt-cinq à court terme225(*), elle souligne toutefois que cette liste ne concerne qu'une faible minorité des médicaments essentiels identifiés.
À cet égard, le Gouvernement déclare poursuivre un travail de recensement des médicaments stratégiques sur les plans industriel et sanitaire (MSIS), consistant à rechercher, parmi les médicaments essentiels identifiés, ceux présentant les chaînes de production les plus fragiles.
Auditionné par la commission d'enquête, le
sous-directeur des industries de santé à la Direction
générale des entreprises a exposé la méthodologie
suivie : « La DGE mène avec l'ANSM une analyse de la
vulnérabilité industrielle de la chaîne
d'approvisionnement, en prenant en compte notamment la dépendance aux
approvisionnements extra-Union européenne. Pour cela, on s'appuie sur
des analyses des ruptures et des sites de production de ces médicaments
afin d'identifier ceux dont la chaîne de production est la plus
fragile.
Enfin, nous faisons le lien avec les industriels du CSF
pour qu'ils mettent notre analyse à l'épreuve, qu'ils
étudient les causes profondes des vulnérabilités, ainsi
que la faisabilité et le coût d'une éventuelle
relocalisation. »226(*)
Plus largement, la relocalisation durable des chaînes de production et la lutte contre les facteurs structurels des pénuries supposeront de s'interroger sur les modalités actuelles de régulation de dépenses de médicaments, sur les responsabilités respectives de l'ensemble des acteurs de la chaîne de production et d'approvisionnement ainsi que sur les moyens de renforcer la gouvernance française et la coopération européenne en la matière. Sur l'ensemble de ces points, la stratégie de l'État doit désormais être refondée en tenant compte de la liste établie, et des actions rapidement planifiées pour assurer la disponibilité des médicaments essentiels. Ces questions font l'objet de développements dans la troisième partie du présent rapport.
Recommandation n° 5 : Finaliser rapidement le travail engagé de recensement des médicaments stratégiques sur les plans industriel et sanitaire (MSIS) et assortir la liste de médicaments essentiels de mesures renforcées améliorant l'anticipation et la gestion des risques de pénurie.
* 205 Article L. 5111-4 du code de la santé publique.
* 206 Article L. 5121-31 du code de la santé publique.
* 207 Article L. 5121-32 du code de la santé publique.
* 208 Articles L. 5121-29 et R. 5124-49-4 du code de la santé publique.
* 209 Audition de M. Bruno Bonnemain, président de l'Académie nationale de pharmacie, Mme Carine Wolf-Thal, présidente du Conseil national de l'ordre des pharmaciens, M. Pierre-Olivier Variot, président de l'Union des syndicats de pharmaciens d'officine, M. Philippe Besset, président de la Fédération des pharmaciens de France, et des docteurs Philippe Meunier, président du Syndicat national des pharmaciens, praticiens hospitaliers et praticiens hospitaliers universitaires (SNPHPU) et Élise Remy, membre du conseil d'administration du Syndicat national des pharmaciens des hôpitaux (Synprefh), le 21 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230320/ce_penurie.html#toc1
* 210 Arrêté du 27 juillet 2016 fixant la liste des classes thérapeutiques contenant des médicaments d'intérêt thérapeutique majeur mentionnés à l'article L. 5121-31 du code de la santé publique.
* 211 Articles L. 5121-31 et R. 5124-49-5 du code de la santé publique.
* 212 CGE et Igas, Les vulnérabilités d'approvisionnement en produits de santé, recommandations n° 3 et 4.
* 213 Jacques Biot, Mission stratégique visant à réduire les pénuries de médicaments essentiels. Rapport au Premier ministre, 18 juin 2020, recommandation n° 4.
* 214 Réponses de la DGS au questionnaire transmis par la commission d'enquête.
* 215 Audition de MM. Marc Childs, président-directeur général, et Thierry Hoffmann, directeur général et pharmacien responsable, du laboratoire Delbert, le 8 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230508/ce_penurie.html#toc2
* 216 https://www.who.int/fr/news/item/27-02-2020-who-launch-e-eml.
* 217 OMS, The Selection et Use of Essential Medicines. Report of the WHO Expert Committee on Selection and Use of Essential Medicines, 2021.
* 218 Executive Ordre on Ensuring Essential Medicines, Medical Countermeasures, and Critical Inputs Are Made in the United States.
* 219 Le site internet du bureau régional de la méditerranée orientale de l'OMS mentionne par exemple les listes de l'Afghanistan, du Bahreïn, de Djibouti, de l'Égypte, de l'Iran, de l'Iraq, de la Jordanie, du Liban, du Maroc, d'Oman et du Pakistan.
* 220 Pénuries de médicaments et de vaccins : renforcer l'éthique de santé publique dans la chaîne du médicament, rapport d'information n° 737 (2017-2018) de M. Jean-Pierre Decool, fait au nom de la MI sur la pénurie de médicaments et de vaccins, déposé le 27 septembre 2018. Proposition n° 1.
* 221 Feuille de route 2019-2022 « Lutter contre les pénuries et améliorer la disponibilité des médicaments en France », action n° 11.
* 222 CGE et Igas, Les vulnérabilités d'approvisionnement en produits de santé, recommandation n° 1.
* 223 Communiqué du ministère de la Santé et de la Prévention « Gestion des pénuries : publication de la liste des médicaments essentiels pour répondre aux besoins prioritaires des Français », 13 juin 2023.
*
224 À cet égard, il faut noter que
le contenu de la liste et l'opacité entourant son établissement
ont fait l'objet de critiques de la part de professionnels de
santé :
https://www.lemonde.fr/societe/article/2023/06/25/medicaments-essentiels-la-liste-du-gouvernement-qui-fache-les-medecins_6179186_3224.html
* 225 Déclaration du Président de la République sur la souveraineté sanitaire et la production de médicaments en France, le 13 juin 2023 : https://www.vie-publique.fr/discours/289895-emmanuel-macron-13062023-medicaments
* 226 Audition de M. Michel Rao, sous-directeur des industries de santé, des biens de consommation et de l'agroalimentaire à la direction générale des entreprises, le 4 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc11