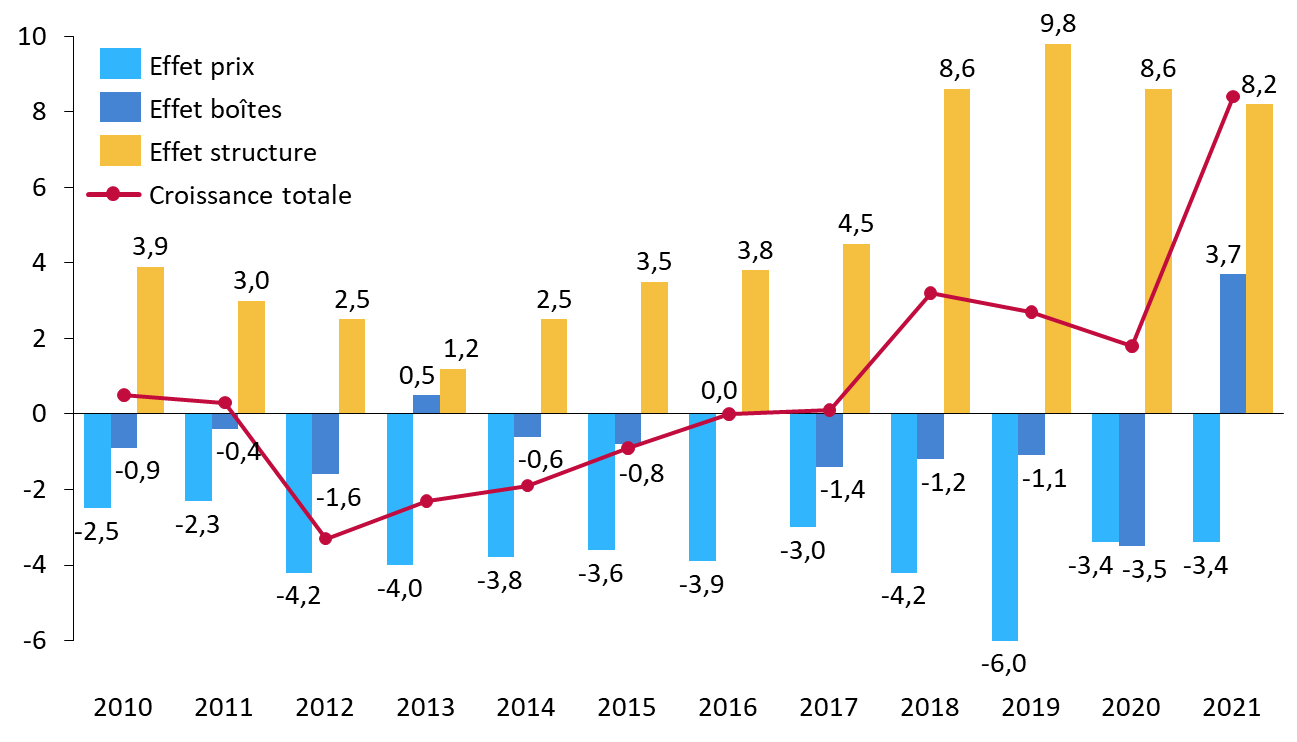TROISIÈME PARTIE
OBJECTIF
« ZÉRO PÉNURIE » :
S'ATTAQUER AUX
CAUSES STRUCTURELLES
DES TENSIONS ET RUPTURES
I. REVOIR LES MODALITÉS DE RÉGULATION DES DÉPENSES DE MÉDICAMENT
A. MIEUX VALORISER LES SPÉCIALITÉS MATURES
1. Des dépenses de médicaments qui tendent à se concentrer sur les produits innovants au prix exorbitant
a) La fixation des prix des médicaments
Après autorisation de leur mise sur le marché, le prix de vente au public des médicaments remboursables est fixé par convention entre l'exploitant et le Comité économique des produits de santé (CEPS) ou, à défaut, par décision de ce dernier, sauf opposition conjointe des ministres concernés387(*).
· Organisme interministériel placé sous l'autorité conjointe des ministres chargés de la santé, de la sécurité sociale et de l'économie, le CEPS réunit diverses administrations et organismes intéressés par la fixation des prix.
Le comité économique des produits de santé (CEPS)
Placé sous l'autorité conjointe des ministres chargés de la santé, de la sécurité sociale et de l'économie, le CEPS est chargé par la loi de fixer les prix des produits de santé. Par ses propositions, il contribue également à la politique économique des produits de santé. Le CEPS assure un suivi périodique des dépenses de médicaments, donnant lieu à au moins deux constats à l'issue des quatre et huit premiers mois de l'année, afin de vérifier si l'évolution des dépenses est compatible avec le respect de l'Ondam388(*).
Le CEPS est, pour cela, organisé en deux sections : la section du médicament et la section des dispositifs médicaux389(*).
Il comprend390(*) :
- un président et deux vice-présidents, l'un chargé du médicament et l'autre des dispositifs médicaux, nommés pour trois ans par arrêté des ministres chargés de la sécurité sociale, de la santé et de l'économie en raison de leur compétence en économie de la santé ;
- quatre représentants de l'État : le directeur de la sécurité sociale (DSS), le directeur général de la santé (DGS), le directeur général de la concurrence, de la consommation et de la répression des fraudes (DGCCRF), le directeur général des entreprises (DGE) ou leurs représentants ;
- trois représentants des caisses nationales d'assurance maladie désignés par l'Union nationale des caisses d'assurance maladie (Uncam) ;
- un représentant de l'Union des organismes d'assurance maladie complémentaire (Unocam).
Peuvent, par ailleurs, assister aux réunions du comité, avec voix consultative, les représentants d'autres administrations (direction générale de l'offre de soins, direction générale de la cohésion sociale, ministères chargés de la recherche, du budget, de l'agriculture, des petites et moyennes entreprises, etc.).
Le président est chargé de rechercher l'accord des membres du comité sur les dossiers qui lui sont présentés. En cas de désaccord, les décisions sont prises à la majorité simple, la voix du président étant prépondérante en cas de partage égal391(*).
Il apparaît ainsi que, si le CEPS « rassemble trois organismes payeurs (la Cnam, l'Unocam et la DSS, qui possèdent cinq voix) et trois directions qui possèdent une voix chacune (la DGS, la DGE, la DGCCRF) »392(*), seule la DGS est susceptible d'y porter une approche strictement sanitaire. la surreprésentation des administrations financières et organismes payeurs au sein du comité pose problème dans la mesure où son activité de tarification constitue un enjeu essentiel des politiques de santé publique.
Les ressources dont bénéficie le CEPS sont par ailleurs apparues très faibles au regard de l'importance de cette activité. Si le Comité « peut s'appuyer sur les compétences [des] organismes » qui le composent, il ne dispose que d'une équipe permanente de « vingt-cinq personnes, à la fois pour le médicament et le dispositif médical », dont seulement quatre cadres évaluateurs chargés de la tarification des médicaments et trois pour les dispositifs médicaux393(*).
La Cour des comptes, constatant leur faiblesse, proposait déjà en 2017 de « donner au CEPS les moyens nécessaires », afin « de disposer de sources d'information plus larges et d'être en mesure de mieux contre-expertiser une partie des informations communiquées par les entreprises pharmaceutiques ».394(*)
· La fixation du prix est encadrée par des critères légaux et réglementaires, par des orientations ministérielles transmises au Comité395(*), ainsi que par un accord-cadre conclu entre le CEPS et Les Entreprises du médicament (Leem)396(*).
Les critères de fixation du prix des médicaments
1. Les critères légaux et réglementaires
L'article L. 162-16-4 énumère six critères de fixation du prix, qui sont applicables aux médicaments vendus en officine comme, à l'hôpital, aux médicaments en rétrocession397(*) ou de la liste en sus398(*) :
- l'amélioration du service médical rendu (ASMR) par le médicament par rapport aux comparateurs cliniquement pertinents399(*), appréciée par la commission de la transparence (CT) de la Haute Autorité de santé (HAS)400(*) : majeure (ASMR I), importante (ASMR II), modérée (ASMR III), mineure (ASMR IV) ou inexistante (ASMR V) ;
- le cas échéant, les résultats de l'évaluation médico-économique conduite par la commission d'évaluation économique et de la santé publique (CEESP) de la HAS, pour les médicaments présumés innovants ou susceptibles d'avoir un impact significatif sur les dépenses d'assurance maladie401(*) ;
- le prix des comparateurs cliniquement pertinents ;
- les volumes de vente prévus ou constatés ;
- les conditions prévisibles et réelles d'utilisation du médicament ;
- le cas échéant, la sécurité d'approvisionnement du marché français que garantit l'implantation des sites de production.
Ce dernier critère, dit « industriel », vise à encourager les relocalisations et a été ajouté par le législateur à l'occasion de la LFSS pour 2022402(*).
Les médicaments qui n'apportent ni bénéfice thérapeutique (ASMR V), ni économie dans le coût du traitement, ne peuvent pas être inscrits au remboursement403(*).
2. Les orientations ministérielles
La dernière lettre d'orientation ministérielle a été transmise au CEPS en février 2021404(*). Tenant compte des graves difficultés survenues durant la crise sanitaire, et reprenant certaines des missions traditionnellement fixées au comité, celle-ci invite notamment le CEPS :
- à conclure « dans les prochains mois » un nouvel accord-cadre avec les représentants des entreprises ;
- à assurer l'accès des patientes et des patients aux traitements, notamment innovants ;
- à favoriser la pérennité de la disponibilité des produits matures ;
- à tenir compte de la contrainte budgétaire, « dans un contexte d'innovations thérapeutiques potentiellement coûteuses ».
3. L'accord-cadre conclu avec le Leem
Conformément à la commande ministérielle, un nouvel accord-cadre a été conclu entre le CEPS et le Leem le 5 mars 2021. L'accord-cadre a vocation à préciser, dans le cadre légal et réglementaire existant, les conditions de fixation des prix afin d'en améliorer la prévisibilité.
D'après le CEPS, la négociation a été guidée par trois priorités405(*) :
- accélérer les délais et simplifier les procédures ;
- mieux reconnaître l'innovation ;
- intégrer la dimension industrielle du médicament, notamment dans une logique de sécurité d'approvisionnement.
Source : Commission d'enquête
· Enfin, le CEPS a établi une doctrine d'application de l'ensemble de ces normes, qu'il explicite dans ses rapports annuels successifs. Il indique, notamment, ne se fonder pour apprécier les critères de tarification, « que sur des avis indépendants et validés sans les remettre en cause ou accepter que l'industriel le fasse »406(*).
Devant la commission d'enquête, le président du CEPS a insisté sur ce point : « Les informations nécessaires pour la fixation initiale d'un prix au regard des critères légaux ne sont pas directement issues des entreprises : elles sont issues de l'avis de la commission de la transparence de la HAS (indication éligible au remboursement, ASMR, comparateur(s), population cible) et le cas échéant de l'avis médico économique de la CEESP. Le comité ne remet pas en doute la validité et l'indépendance de ces avis. Seules les prévisions de ventes de l'industriel constituent une information directe de l'entreprise vers le Comité. À ce titre, plutôt que de contester les prévisions de l'entreprise, le comité préfère s'appuyer sur les clauses volumes introduites dans les contrats qui constituent un moyen de sécuriser des prévisions par nature incertaines. »407(*)
b) Le prix exorbitant de l'innovation thérapeutique
· Le prix exorbitant de certains médicaments innovants a fréquemment été dénoncé devant la commission d'enquête.
La lettre d'orientation ministérielle transmise en 2021 au président du CEPS décrit cette dérive en des termes proches : « Le modèle économique des médicaments a considérablement évolué depuis la création du CEPS. En particulier, les spécialités biologiques destinées à des populations cibles extrêmement réduites ont émergé à côté des médicaments chimiques destinés à des millions de patients, avec des coûts de R&D et de fabrication en forte augmentation. Combiné au raccourcissement du cycle d'exploitation du médicament, ceci contribue à l'augmentation importante des prix des nouveaux traitements, laquelle interroge aujourd'hui la soutenabilité des systèmes de soins dans l'OCDE, l'équité d'accès au traitement et l'allocation des ressources contraintes de la solidarité nationale entre thérapies. »408(*)
Le professeur Alain Fischer, président de l'académie des sciences, a donné de cette inflation plusieurs exemples éclairants lors de son audition par la commission d'enquête.
Le prix très élevé de certains médicaments innovants
(Extrait du compte-rendu de l'audition par la commission d'enquête du Pr Alain Fischer, président de l'Académie des sciences)
« [...] même si les prix des médicaments ne sont pas connus publiquement en France, nous pouvons estimer que la trithérapie contre la mucoviscidose a un coût de 200 000 euros par an, et ceci à vie. Le coût des anticorps monoclonaux administrés dans les traitements du cancer s'élève à 50 000 à 100 000 euros par cure et par malade. Pour les maladies auto-immunes, le coût est de 10 000 à 20 000 euros, pour l'hémophilie à 100 000 euros par malade, pour les CAR-T cells à 400 000 euros, en plus des autres traitements nécessaires. Les nouveaux traitements de l'hémophilie ont été commercialisés aux États-Unis au prix de trois millions de dollars. En France, le traitement contre l'amyotrophie spinale s'élève à 1,9 million d'euros. De nombreux autres exemples pourraient être donnés. »
Source : Commission d'enquête
Plusieurs facteurs expliquent que les prix de certains médicaments innovants puissent atteindre de tels niveaux.
· Les entreprises pharmaceutiques mettent en avant, d'abord, l'augmentation des coûts de recherche et développement et les risques associés au développement d'un nouveau produit. Le Leem fait état, par exemple, de coûts de développement qui augmenteraient de 10 % par an, sous le triple effet de l'enchérissement des études cliniques, de l'allongement de la durée des études et de l'augmentation du taux d'échec dû à la complexité des domaines concentrant aujourd'hui la recherche409(*).
Cette affirmation doit toutefois être relativisée : une étude récente, publiée dans le British Medical Journal, soulignait par exemple qu'entre 1999 et 2018, les 15 plus grandes entreprises pharmaceutiques avaient dépensé 1 400 milliards de dollars en R&D, contre 2 200 milliards de dollars sur la même période en dépenses commerciales, marketing et administratives410(*). Les débats récurrents sur la part réelle des coûts de recherche et développement dans la mise sur le marché d'une spécialité illustrent l'opacité entourant l'économie du médicament, évoquée précédemment.
· Les critères de fixation du prix peuvent avoir, en outre, un effet inflationniste, dans la mesure où la tarification des médicaments innovants est principalement fixée au regard du prix d'un comparateur, auquel il est appliqué une augmentation fonction de l'ASMR constatée. Agnès Buzyn, ministre des solidarités et de la santé de mai 2017 à février 2020, a ainsi comparé le mécanisme de fixation des prix à une « échelle de perroquet » : « À chaque fois qu'apparaît un médicament innovant, s'il apporte le moindre bénéfice thérapeutique par rapport à un médicament existant, l'industriel a le droit d'obtenir un prix supérieur aux médicaments de référence existants. Cette politique de fixation du prix date des années 1970 où l'on voulait promouvoir l'innovation [...]. Quarante ans après, l'innovation a été très importante et connaît une accélération, notamment en cancérologie : un médicament qui apporte trois mois de vie en plus représente l'équivalent de 100 000 dollars, contre 8 000 euros il y a dix ans. »411(*)
· Le rapport de force dans les négociations avec les régulateurs apparaît, de plus, favorable aux industriels. Ceux-ci peuvent, la plupart du temps, s'appuyer sur le soutien des associations de patients, soucieuses de permettre un accès rapide des malades à des traitements susceptibles d'améliorer leur état de santé ou leurs conditions de vie. La journaliste Rozenn Le Saint, auditionnée par la rapporteure, cite ainsi dans son ouvrage Chantage sur ordonnance les propos d'Agnès Buzyn, revenant sur le prix concédé au laboratoire Novartis pour son traitement Zolgensma contre l'amyotrophie spinale : « Les associations qui représentent les patients hurlent car les malades n'ont pas accès à ces médicaments. Au ministère de la santé, vous vous retrouvez entre le marteau et l'enclume. À la fin, vous mettez le prix car vous ne pouvez pas laisser penser que vous privez votre population d'un traitement efficace existant. »412(*)
La Cour des comptes observait ainsi, dès 2017, une évolution des stratégies des entreprises pharmaceutiques en matière de prix : « Dans la négociation, leurs objectifs se sont déplacés de la mise en avant d'un retour sur leurs dépenses investies en recherche et développement vers des demandes de prix établies en fonction de la capacité à payer des acheteurs publics. Ces nouvelles stratégies, plus agressives, exercent une pression inédite sur les financeurs, parfois relayée par la communauté médicale et par les associations de patients qui réclament la mise à disposition rapide de ces innovations. »413(*)
Le sofosbuvir contre l'hépatite C
Le produit emblématique de cette dynamique est resté le Sovaldi, nom commercial du sofosbuvir, premier médicament de la nouvelle génération de traitements contre l'hépatite C - les antiviraux à action directe (AAD) - mise sur le marché en 2014. Certes très efficace, ce traitement commercialisé par la firme Gilead l'est d'abord à un prix public extrêmement élevé : en France, où près de 230 000 personnes vivaient alors avec le virus de l'hépatite C, le montant était de 41 000 euros pour une cure de trois mois.
La Caisse nationale d'assurance maladie observait ainsi, dans son rapport dit « charges et produits » de 2016 : « L'arrivée des nouveaux traitements de l'hépatite C a provoqué une onde de choc dans tous les systèmes de santé. Pour la première fois, la question de l'accès à l'innovation médicamenteuse s'est posée non pas pour des pays en développement ou émergents, mais pour les pays les plus riches. Cette situation inédite a nourri des débats sur la légitimité des niveaux de prix demandés par les industriels, sur les marges de manoeuvre des gouvernements, sur les possibilités d'agir à l'échelle européenne. »414(*)
Source : Commission d'enquête
Dans le même sens, le rapport technique publié en 2019 par l'OMS sur le prix des anticancéreux415(*) montrait que les prix de ces médicaments sont fixés par les groupes pharmaceutiques « en fonction de leurs objectifs commerciaux, avec la volonté d'obtenir le montant maximum qu'un acheteur peut payer pour un médicament », donc en fonction de la « disposition à payer » de chaque système de santé.
· Enfin, les industriels mettent en avant la valeur transformative de certaines thérapies innovantes, susceptibles de guérir des maladies faisant jusque-là l'objet d'un traitement chronique, et les économies qu'elles peuvent générer pour les systèmes d'assurance maladie. Olivier Véran, ministre des solidarités et de la santé de février 2020 à mai 2022, a ainsi livré à la commission d'enquête un témoignage éclairant : « Puis, en 2014, le Sovaldi, médicament contre l'hépatite C, a été commercialisé par le laboratoire Gilead. Nous étions enthousiasmés par ce nouveau produit capable de guérir des patients qui n'arrivaient pas à se soigner. Mais le prix très élevé du médicament a entraîné une dépense de l'ordre d'un milliard d'euros, somme qui ne peut financer d'autres produits, dont le prix devra donc nécessairement chuter [...]. Au cours de la conversation, confronté à mon mécontentement, le dirigeant de Gilead avait fait valoir les économies générées par ce nouveau produit en greffes et les gains d'espérance de vie, ce à quoi j'avais répondu qu'un tel raisonnement poussé à l'extrême conduirait aussi à prendre en compte les dépenses de retraite supplémentaires induites par les patients guéris. »416(*)
Les difficultés de tarification des médicaments « one shot »
Le CEPS fait état, dans son rapport annuel, des difficultés attachées à la tarification des médicaments « one shot », qui se positionnent en alternative à des traitements chroniques. Celles-ci tiennent notamment :
- à une appréciation délicate de l'horizon temporel devant être retenu ;
- à un haut niveau d'incertitude entourant la permanence de tout ou partie de l'effet du traitement.
Il souligne la nécessité de disposer d'une évaluation médico-économique fournie par la commission d'évaluation économique et de santé publique (CEESP), qui constitue « la seule approche scientifique et indépendante de cette comparaison [entre le médicament innovant et les alternatives thérapeutiques disponibles] et [permet] l'identification des éléments clefs en matière d'incertitude ». En conséquence, le CEPS indique souhaiter disposer de ces évaluations le plus souvent possible417(*).
Source : Commission d'enquête
c) Une progressive concentration des dépenses sur les produits innovants
Cette inflation tarifaire alimente une progressive déformation des dépenses de médicaments de l'Assurance maladie au profit des spécialités les plus innovantes et les plus onéreuses. Deux manifestations principales de cet effet peuvent être distinguées :
- l'augmentation des ventes de médicaments en officine de ville, principalement portée par la croissance de nouvelles molécules onéreuses ;
- pour les établissements de santé, la progression rapide de la « liste en sus », qui rassemble les molécules les plus onéreuses financées indépendamment de la tarification à l'activité (T2A).
· S'agissant de la ville, le CEPS décompose ainsi, chaque année, l'évolution observée des ventes en trois effets distincts :
- l'effet prix correspondant à l'évolution des prix unitaires ;
- l'effet boîtes correspondant à l'évolution du nombre de boîtes vendues ;
- l'effet structure rendant compte de l'évolution des parts de marché respectives des médicaments : un effet structure positif reflète un déport des ventes vers les spécialités les plus onéreuses (notamment les innovations), un effet négatif reflète un déport vers les spécialités les moins onéreuses (par exemple, les génériques).
L'effet structure apparaît, depuis 2010, constamment positif : alors que le prix moyen et le nombre de boîtes vendues diminuent régulièrement, la déformation des ventes vers les spécialités onéreuses explique presque intégralement le dynamisme des ventes en ville ces dernières années.
Décomposition de l'évolution des ventes en ville en « effet prix », « effet boîtes » et « effet structure » (2010-2021)
(en % de croissance)
Source : Commission d'enquête, d'après des données CEPS
D'après le CEPS, nous assistons ainsi à un « essor des médicaments onéreux en officine de ville » : les médicaments dont le prix fabricant hors taxe (PFHT) est supérieur à 1 930 euros, qui représentent moins de 0,1 % des volumes de vente, concentreraient ainsi 22,6 % du chiffre d'affaires418(*).
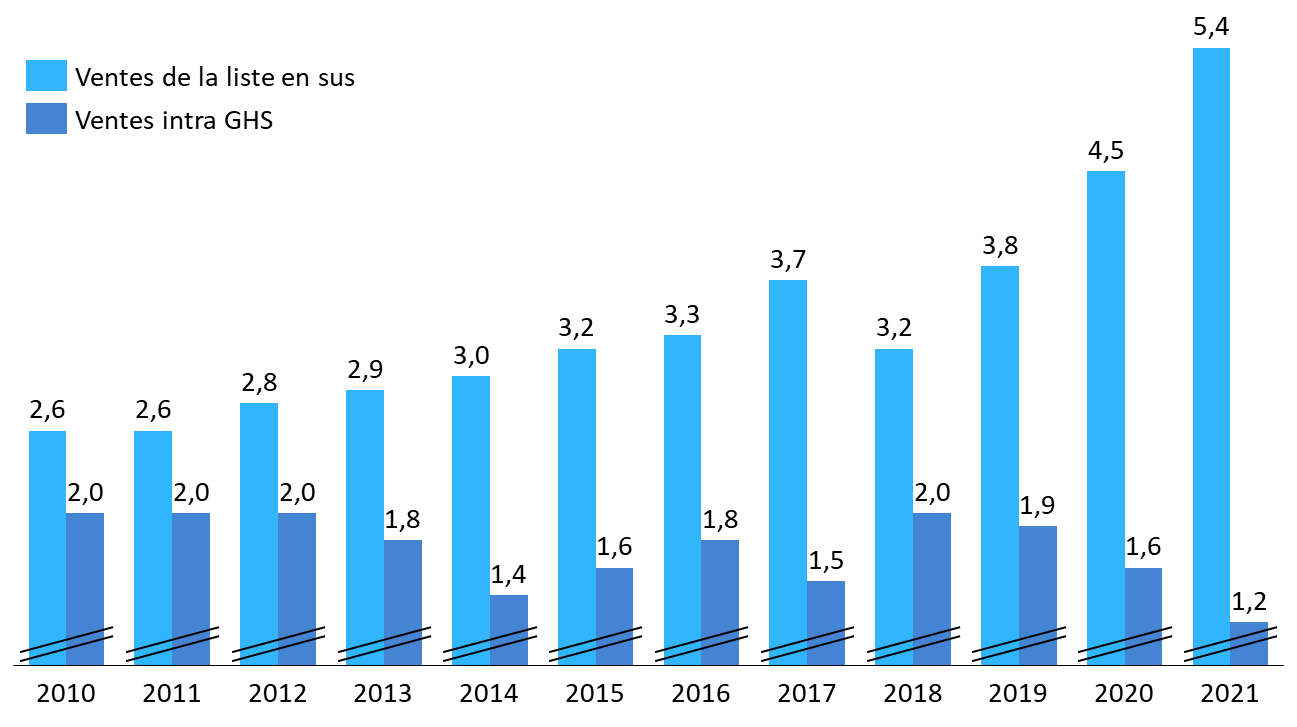
· À l'hôpital, le même effet de concentration du chiffre d'affaires sur les spécialités les plus onéreuses peut être observé.
D'une part, la part des ventes hospitalières relevant de la liste en sus, qui rassemble les spécialités les plus onéreuses financées indépendamment de la T2A (ou « hors groupes homogènes de séjour (GHS) »), ne cesse de croître. En 2010, les ventes intégrées à la T2A (ou « intra GHS ») s'élevaient à 1,8 milliard d'euros, contre 2,4 milliards d'euros pour la liste en sus. En 2021, l'écart a été multiplié par 7 : les ventes intra GHS ne représentent plus que 1,2 milliard d'euros, alors que celles de la liste en sus s'élèvent à 5,4 milliards d'euros.
Ventes de médicaments sous Ondam hospitalier, intra GHS et sur liste en sus (2010-2021)
(en milliards d'euros)
Source : Commission d'enquête, d'après des données CEPS
D'autre part, les ventes relevant de la liste en sus apparaissent, elles-mêmes, très concentrées sur quelques spécialités onéreuses. D'après le CEPS, dix spécialités concentrent ainsi 60 % des dépenses de la liste en sus en 2021 : Keytruda, Opdivo, Darzalex, Soliris, Perjeta, Privigen, Ocrevus, Imfinzi, Tacentriq et Kadcyla419(*).
d) Lutter contre les stratégies abusives des laboratoires en usant des flexibilités prévues par le régime des brevets
Lorsque l'accès aux innovations représente un impératif de santé publique, les barrières à l'entrée que constituent les règles relatives à la protection des brevets, et les prix exorbitants qu'elles permettent aux laboratoires de solliciter, suscitent des critiques légitimes, d'autant plus aiguës que la crise sanitaire de la covid-19 a fait de la disponibilité des vaccins et traitements nouveaux un enjeu majeur.
De nombreux acteurs, à commencer par l'ONG Médecins du monde, critiquent ainsi le non-usage des outils de régulation qui, prévus dans les accords sur les aspects des droits de propriété intellectuelle (ADPIC) comme dans la loi française, sont pourtant en principe à la disposition de l'État pour contrôler les prix abusifs des médicaments sous brevet.
D'éventuelles qualifications de certaines pratiques de prix excessifs en cas d'abus de position dominante420(*) exigeraient une coordination entre le CEPS et l'Autorité de la concurrence ou la direction générale de la concurrence de la Commission européenne. Mais c'est surtout la persistante non-utilisation par les autorités françaises de l'outil de la licence d'office, pourtant inscrit dans notre droit depuis 1959421(*) et dans le code de la propriété intellectuelle depuis 1968422(*), qui fait débat.
L'article L. 613-16 du code de la propriété intellectuelle
« Si l'intérêt de la santé publique l'exige et à défaut d'accord amiable avec le titulaire du brevet, le ministre chargé de la propriété industrielle peut, sur la demande du ministre chargé de la santé publique, soumettre par arrêté au régime de la licence d'office tout brevet délivré pour un médicament, un dispositif médical, un dispositif médical de diagnostic in vitro, un produit thérapeutique annexe ; leur procédé d'obtention, un produit nécessaire à leur obtention ou un procédé de fabrication d'un tel produit ; une méthode de diagnostic ex vivo [...] lorsque ces produits ou [...] méthodes sont mis à la disposition du public en quantité ou qualité insuffisantes ou à des prix anormalement élevés, ou lorsque le brevet est exploité dans des conditions contraires à l'intérêt de la santé publique ou constitutives de pratiques déclarées anticoncurrentielles à la suite d'une décision administrative ou juridictionnelle devenue définitive. Lorsque la licence a pour but de remédier à une pratique déclarée anticoncurrentielle ou en cas d'urgence, le ministre chargé de la propriété industrielle n'est pas tenu de rechercher un accord amiable. »
Or, comme l'a expliqué Juliana Veras, coordinatrice de Médecins du monde, devant la commission d'enquête, les gouvernements successifs « n'ont pas su ou voulu se saisir de cet outil. Ils n'ont même jamais créé les conditions réglementaires de sa mise en oeuvre, ce qui, de fait, vide cet outil négociation de sa puissance. »423(*) L'article R. 613-10 du code de la propriété intellectuelle prévoit en effet, à titre de condition requise pour que cette option soit mobilisable, la création d'une commission chargée d'apprécier les cas concrets de licence d'office et, le cas échéant, de rendre un avis motivé sur l'arrêté pris par le ministre chargé de la propriété intellectuelle sur la demande du ministre chargé de la santé publique. Mais cette commission, consacrée dans notre droit depuis la publication d'un décret du 18 octobre 1969, dont l'existence juridique a été confirmée dans un décret du 10 avril 1995, n'a jamais été installée. À défaut, les possibilités effectives de déclencher ou de menacer de déclencher une licence d'office en France demeurent inopérantes.
Le contexte de la crise sanitaire de la covid-19 pourrait avoir changé la donne. L'introduction dans le code de la santé publique, par la loi du 23 mars 2020 d'urgence pour faire face à la pandémie de covid-19, de l'article L. 3131-15, dont le 9° autorise le Gouvernement, « en tant que de besoin, [à] prendre toute mesure permettant la mise à la disposition des patients de médicaments appropriés pour l'éradication de la catastrophe sanitaire », indique en effet un chemin de mobilisation du cadre légal de la licence d'office, même s'il reste cantonné au contexte strict de la pandémie. Un collectif de juristes a d'ailleurs récemment proposé une série d'aménagements et d'adaptations de ce cadre légal afin de lui rendre toute sa robustesse424(*).
· Si, au moment des rationnements des traitements contre l'hépatite C, en 2014, la licence d'office s'est vue comparer à la « bombe atomique », l'expérience de la pandémie de covid-19 semble bien avoir témoigné d'un changement d'attitude à l'égard de cet outil.
Le contexte de la crise sanitaire mondiale a en effet été propice à la relance d'une vision plus souple et plus flexible des règles relatives aux brevets au niveau international. L'OMS a ainsi annoncé, le 29 mai 2021, la création du « pool d'accès aux technologies covid-19 » (C-TAP) en application des objectifs de l'« accélérateur de l'accès aux outils de lutte contre le covid-19 » (ACT-A). À propos de cette initiative, le Président de la République lui-même avait annoncé, en mai 2021, qu'il ne devrait y avoir « aucun tabou, aucune idéologie [...]. À chaque fois que la propriété intellectuelle est un obstacle à la production, nous devons y apporter une réponse, comme nous avons su le faire jadis sur la production des trithérapies face au VIH. C'est pourquoi je demande à ce que les travaux d'ACT-A sur la production des outils covid puissent faire l'objet d'un rapport conjoint incluant les analyses de l'OMC et de l'OMS devant le G20 [...]. Si ces conclusions impliquent de faire usage de nouvelles mesure en matière de propriété intellectuelle, évidemment je les soutiendrai. »425(*)
Reste que cet apparent changement d'orientation ne s'est pas traduit dans les actes. Roland Lescure, ministre chargé de l'industrie, a d'ailleurs repris à son compte, devant la commission d'enquête l'antienne de la « bombe atomique » : « nous avons considéré que, face à une pénurie globale, cette arme s'apparentait à une bombe atomique. À l'heure où l'Europe entière connaissait des pénuries de paracétamol, l'instrument risquait d'être contreproductif [...] Cet outil existe, mais on ne doit le manier que d'une main tremblante. [...] La capacité de l'État à reprendre en main la capacité de production de médicaments s'apparente à une arme de destruction massive. Il faut pouvoir le faire [...]. Mais, si l'on pourrait imaginer ce type de démarche à l'échelle européenne, l'utilisation solitaire et trop fréquente de telles prérogatives serait susceptible de conduire la France à se faire pas mal d'ennemis, y compris dans les pays adjacents »426(*).
· Paradoxalement, alors que les discours en faveur de l'acceptabilité de la licence d'office avaient commencé à occuper le devant de la scène politique pendant la pandémie de covid-19, on observe désormais un reflux manifeste.
Ainsi la demande, formulée en novembre 2021 par l'AFM-Téléthon, d'émission d'une licence d'office sur la thérapie génique Skysona, indiquée dans le traitement de l'adrénoleucodystrophie cérébrale liée à l'X, n'a-t-elle reçu aucune réponse de la part du gouvernement français, alors qu'après avoir obtenu une autorisation de mise sur le marché en Europe le laboratoire américain Bluebird Bio, qui exploite le Skysona, avait unilatéralement décidé d'abandonner sa commercialisation en Europe pour se consacrer au seul marché américain. « C'est d'autant plus choquant que [ce produit] étai[t] iss[u] de la recherche académique française »427(*), précise Christophe Duguet, représentant de l'AFM-Téléthon, lors de son audition428(*). Dans un courrier adressé par l'association au ministre de la santé et de la prévention et cosigné avec les principaux cliniciens prenant en charge les malades concernés, il était demandé au Gouvernement « de prendre d'urgence les mesures appropriées permettant qu'un laboratoire français puisse produire ces traitements et les mettre à disposition des patients, dans des conditions de prix transparentes. Pour cela, il est nécessaire d'agir pour donner accès à l'ensemble des données d'enregistrement de ces produits et si besoin octroyer des licences obligatoires pour les brevets qui pourraient être bloquants. » Ce courrier « n'a obtenu aucune réponse »429(*)...
· La licence d'office n'est nullement une expropriation : il s'agit bien d'un contrat par lequel le titulaire du brevet - le breveté - concède à un tiers - le licencié - le droit d'exploiter son invention moyennant le versement d'une redevance. Simplement, si le breveté est en principe libre de conclure ou non un tel contrat, par exception, la conclusion d'un accord de licence peut lui être imposée dans l'intérêt de la santé publique : c'est ce qui se passe dans le cas de la licence d'office.
En outre, le mécanisme des licences d'office, loin d'être en contravention avec le droit international, s'inscrit pleinement dans celui-ci, et notamment, depuis 1994, dans l'Accord sur les aspects des droits de propriété intellectuelle (ADPIC) signé dans le cadre de l'Organisation mondiale du commerce, à l'article 31 (« Autres utilisations sans autorisation du détenteur du droit »). La Convention de Paris pour la protection de la propriété industrielle reconnaissait d'ailleurs déjà aux pays signataires, à l'article 5, la faculté d'accorder des licences obligatoires « pour prévenir les abus qui pourraient résulter de l'exercice du droit exclusif conféré par le brevet, par exemple faute d'exploitation »430(*).
Qui plus est, comme l'écrit le Groupe de haut niveau du secrétaire général des Nations Unies sur l'accès aux médicaments, la « déclaration sur l'accord sur les ADPIC et la santé publique », dite déclaration de Doha, qui date de 2001, « confirme que les flexibilités ADPIC ne sont pas des exceptions, mais plutôt une partie fondamentale du mécanisme des ADPIC »431(*).
Il paraît à tout le moins indispensable que cet outil de dissuasion, déjà prévu dans le droit national comme dans le droit international, soit sinon mobilisé, du moins mobilisable : à supposer que la commission de la licence d'office prévue à l'article R. 613-10 du code de la propriété intellectuelle soit créée, ses avis seraient un appui pour le CEPS dans l'exercice de son pouvoir de négociation et permettraient de rééquilibrer les rapports de force entre les décideurs publics et les industriels du médicament, notamment dans les cas où ceux-ci cherchent à obtenir des prix injustifiés pour la vente de médicaments.
Les conditions dans lesquelles l'Égypte est parvenue à obtenir l'import à un prix faible du Sovaldi constituent une illustration éclairante de l'utilité de la licence d'office dans des négociations.
Accès aux nouveaux traitements contre l'hépatite C : l'exemple égyptien d'une mobilisation sous pilotage public réussie
Lors de leur audition, les cofondateurs de l'Observatoire de la transparence dans les politiques du médicament ont attiré l'attention de la commission sur les spécificités de la politique du médicament en Égypte, notamment en matière de délivrance des brevets et de production de médicaments sous impulsion publique.
Dans le cadre d'une réflexion sur l'élaboration d'une stratégie européenne de production des médicaments d'intérêt thérapeutique majeur, Pauline Londeix a ainsi érigé l'Égypte en modèle d'une « production [...] privée, mais [...] réalisée en articulation très intelligente avec les pouvoirs publics et les bureaux des brevets, avec une volonté politique forte de faire accéder la population à des médicaments vitaux »432(*). La commission a pu vérifier l'intérêt de cette expérience volontariste de mise à disposition d'un traitement innovant en auditionnant le président-directeur général d'une entreprise sociale égyptienne du secteur de la santé, la société Shamseya433(*).
C'est en particulier pour sa réussite dans la lutte contre l'hépatite C, dans un pays où la prévalence de la maladie était la plus élevée au monde434(*), et pour sa capacité à mettre à la disposition de sa population le fameux sofosbuvir, que l'Égypte est souvent citée en exemple, et est même devenue une destination de tourisme médical.
Le bureau des brevets égyptien, considérant dès 2014 que ce traitement découlait de l'état des connaissances pharmacologiques - et suivant en cela l'exemple indien -, a d'abord refusé d'accorder un brevet au laboratoire états-unien Gilead pour son Sovaldi, vendu à des prix exorbitants aux États-Unis et en Europe.
Au même moment, le 21 mai 2014, un brevet était pourtant accordé par l'Office européen des brevets (OEB) pour le promédicament du Sovaldi. La suite allait néanmoins montrer que la revendication afférente était au moins en partie illégitime, Médecins du monde formant opposition pour manque d'« activité inventive » dans le cadre de deux procédures différentes, en février 2015 (demande de révocation du brevet relatif au promédicament) et en mars 2017 (pour le brevet relatif au composé de base, quant à lui validé par l'OEB en juin 2016), et la chambre de recours de l'Office confirmant finalement, le 24 novembre 2022 - après un premier jugement rendu en octobre 2016 -, la fragilité du brevet d'origine et l'exclusion de son périmètre de deux des trois molécules qui y étaient couvertes, dont le sofosbuvir lui-même.
L'Égypte, quant à elle, en tant que pays à revenu intermédiaire, n'était ni couverte par la « licence volontaire » octroyée par Gilead à soixante pays, pour la plupart à faible revenu, ni capable de payer le prix exorbitant consenti par les pays à revenu élevé.
Compte tenu du considérable manque à gagner qu'aurait représenté la perte du marché égyptien et de ses très importants volumes, et mis sous pression par la jurisprudence indienne et les menaces de mobilisation de l'outil de la licence obligatoire, le laboratoire accepte dès juillet 2014 de conclure un accord avec le pays, proposant de l'approvisionner à un prix inférieur de 99 % à celui auquel le médicament était vendu aux États-Unis. Dès l'année suivante, le gouvernement égyptien opte pour la production locale de génériques de ces nouveaux traitements antiviraux à action directe, confiée au producteur privé Pharco, et parvient à les fournir à la population à des prix publics plus de 500 fois inférieurs à ceux qui sont à l'époque pratiqués dans certains pays à haut revenu435(*), réalisant d'immenses progrès dans l'éradication de la maladie.
Fort de cette expérience, le laboratoire égyptien Pharco a par la suite développé, en collaboration avec l'ONG « Initiative médicaments contre les maladies négligées » (DNDi), un nouveau médicament contre l'hépatite C, le ravidasvir, dont la phase d'essais cliniques, menée en Malaisie et en Thaïlande, s'est révélée très concluante.
Source : Commission d'enquête
Les modalités d'activation possible d'une telle « arme » devront en tout état de cause faire l'objet de réflexions, notamment au niveau européen, comme l'a suggéré Marc Botenga, député européen, lors de son audition436(*).
2. Pour maîtriser les dépenses de médicaments, des baisses de prix importantes engagées sur les produits matures
a) Un moyen efficace de régulation des dépenses de médicament, qui pèse essentiellement sur les produits matures
Pour financer cette très forte croissance des spécialités innovantes et onéreuses, le CEPS conduit chaque année des campagnes de baisses de prix visant à atteindre l'objectif d'économies proposé par le Gouvernement et adopté par le Parlement en LFSS.
Or en visant les spécialités matures, ces campagnes accentuent encore la concentration du marché sur les médicaments innovants.
· Dans un objectif de prévisibilité, le CEPS limite les baisses de prix aux situations visées par les critères légaux et réglementaires, par l'accord-cadre de 2021, par la lettre d'orientation ministérielle, ou encore à ceux prévus conventionnellement avec l'entreprise concernée.
Les situations dans lesquelles le CEPS est susceptible de demander une baisse de prix
1. Les critères généraux de baisse de prix fixés par la loi
Depuis la loi de financement de la sécurité sociale pour 2017, le code de la santé publique liste les critères généraux pouvant motiver une baisse de prix :
- l'ancienneté de l'inscription de la spécialité concernée ou des médicaments à même visée thérapeutique, ou l'expiration du brevet, notamment en cas de commercialisation d'un premier générique ;
- le prix net ou le tarif net de la spécialité et des médicaments à même visée thérapeutique ;
- le prix d'achat constaté de la spécialité ou des médicaments à même visée thérapeutique par les hôpitaux ou les distributeurs de gros ou de détail ;
- le coût net du traitement pour l'Assurance maladie lorsque la spécialité concernée est utilisée avec d'autres médicaments, au regard du coût net des traitements à même visée thérapeutique ;
- les montants remboursés, prévus ou constatés, par l'Assurance maladie pour le médicament concerné et ceux à même visée thérapeutique ;
- l'existence de prix ou de tarifs inférieurs dans d'autres marchés européens de taille comparable ;
- en cas d'importation ou de distribution parallèles.
2. Les situations spécifiques pouvant justifier une baisse des prix
Les baisses de prix peuvent, d'abord, être prévues par la convention dès la fixation tarifaire initiale, afin notamment :
- de maintenir le coût réel par malade au niveau initialement convenu (clauses de coût de traitement journalier) ;
- de maintenir les quantités vendues au niveau de la cible médicalement justifiée (clauses de volume)437(*) ;
- de tenir compte de l'effet budgétaire probable d'un médicament, pouvant justifier la conclusion de clauses inconditionnelles de baisse de prix.
Par ailleurs, plusieurs situations peuvent, postérieurement, justifier une baisse de prix à l'initiative du comité :
- les remises conventionnelles ont ainsi vocation à être transformées en baisse pérenne de prix, à l'issue d'une période fixée par l'accord-cadre438(*) et au plus tard à la date d'inscription au répertoire du premier générique ;
- lorsque l'évaluation des dépenses de médicaments n'est manifestement pas compatible avec le respect de l'Ondam439(*) ;
- en cas de modification significative des données scientifiques et épidémiologiques prises en compte pour la conclusion des conventions ;
- à l'occasion d'une réévaluation par la CT de la HAS ;
- suite à la mise sur le marché, après l'inscription, de médicaments concurrents aussi efficaces et moins coûteux.
3. La commercialisation des premiers génériques
L'entrée sur le marché de génériques, suite à l'expiration du brevet, conduit en principe440(*) :
- à ce que le prix des génériques soit fixé à 60 % du prix de la spécialité de référence ;
- à une baisse immédiate du prix de la spécialité de référence de 20 % sauf si cela conduit à un écart trop faible avec les génériques commercialisés ;
- à l'application, après dix-huit mois de commercialisation, d'une baisse de prix de 12,5 % sur le princeps et 7 % sur les génériques ;
- à la réduction de l'écart de prix entre princeps et générique après cinq ans de commercialisation effective des génériques.
Source : Commission d'enquête
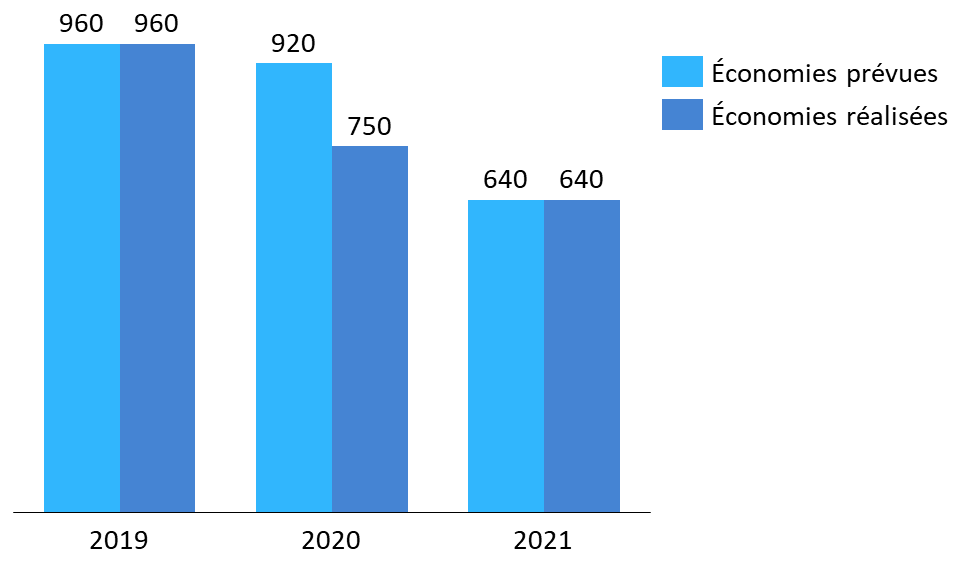
· Les campagnes de baisse de prix réalisées chaque année par le CEPS, sur les médicaments, parviennent généralement à atteindre l'objectif d'économies fixé par le Gouvernement et le Parlement, et ainsi à maîtriser le dynamisme des dépenses de médicaments pour rapprocher la croissance naturelle du secteur de la croissance ciblée en LFSS.
En 2019 comme en 2021, les objectifs respectifs de 960 millions d'euros et 640 millions d'euros d'économies permises par baisses de prix ont ainsi été tenus par le CEPS.
Économies prévues en LFSS et réalisées par baisses de prix (2019-2021)
(en millions d'euros)
Source : Commission d'enquête, d'après des données DSS et d'après les annexes aux PLFSS pour 2019, 2020 et 2021
· En raison des critères fixés, et en application des orientations ministérielles invitant le CEPS à procéder « régulièrement à des réajustements fondés notamment sur la concurrence par les prix et la prise en compte de l'ancienneté des produits »441(*), les baisses de prix pèsent toutefois essentiellement sur les produits matures, pourtant souvent indispensables à la prise en charge des patientes et des patients.
À cet égard, la question de la rentabilité des médicaments anciens et essentiels a fréquemment été soulevée devant la commission d'enquête. Le Gemme a par exemple souligné la faible rentabilité des génériques lors de son audition : « L'industrie du générique se caractérise par un volume et un portefeuille de produits importants - plus d'un médicament sur deux distribués en officine est générique -, un niveau de prix bas et une faible rentabilité. »442(*)
Le laboratoire UPSA a également souligné la faible rentabilité du paracétamol qu'il commercialise, notamment dans sa forme pédiatrique : « Notre prix de fabrication hors taxes s'élève à 76 centimes, alors que le paracétamol est vendu en officine 2,18 euros. À ces 76 centimes s'ajoutent ainsi la marge du grossiste, celle du pharmacien, la TVA et les honoraires de dispensation du pharmacien rémunérant l'acte pharmaceutique [...]. Aujourd'hui, nos produits n'atteignent pas un seuil de rentabilité très élevé. Celui de la pédiatrie est même négatif. »443(*)
· Interrogé sur le niveau de prix des médicaments matures et le poids des campagnes de baisses de prix, le CEPS met en avant trois séries d'arguments au soutien de cette politique.
D'abord, la réduction progressive du prix au cours du cycle de vie d'un médicament reproduirait un mécanisme habituel de marché, indispensable à la maîtrise des dépenses d'Assurance maladie. Le président du CEPS explique ainsi que « sur un marché qui n'est pas administré, l'arrivée de nouveaux concurrents a de très fortes chances de perturber le modèle existant et d'entraîner une évolution à la baisse des prix. C'est ainsi que les choses se passent ! Nous comprenons donc qu'il faille préserver des marges sur les produits anciens, mais cela ne remet pas en cause une régulation prenant en compte un critère d'ancienneté. »444(*)
Ensuite, les baisses de prix seraient décidées au cas par cas, et après consultation des entreprises concernées. Le président du CEPS a, à cet égard, décrit à la commission d'enquête la procédure suivie en indiquant travailler sur le plan de baisse « [dès] juillet, en amont des arbitrages », afin « d'identifier les classes thérapeutiques qui pourraient être concernées, en prenant en compte des critères légaux, notamment l'ancienneté, les baisses opérées l'année précédente ou l'évolution de la dépense dans un secteur donné. » La liste des classes identifiées est ensuite communiquée « au Leem et aux entreprises et, dès le mois d'août, [sont entamés] des échanges avec elles sur les pourcentages de baisse envisagés »445(*). Ceux-ci ont notamment lieu au sein du comité de suivi des génériques.
Le comité de suivi des génériques (CSG) : une instance de concertation
En application de l'accord-cadre446(*), le CSG a notamment pour objet :
- d'examiner le développement du marché des génériques et analyser les conditions économiques qui prévalent pour les entreprises concernées ;
- de proposer les modalités et le périmètre d'application des règles de fixation et d'évolution des prix des médicaments génériques ;
- d'analyser et suivre le montant d'économies générées par les génériques en prenant en considération les évolutions des prix et des volumes ;
- d'en tirer des recommandations pour s'assurer que la politique de prix du médicament générique tient compte des évolutions du marché, en volume et en valeur, permettre la viabilité des acteurs et satisfaire un niveau de sécurité sanitaire élevé.
Le CSG est consulté sur tout projet collectif de baisses de prix des médicaments génériques envisagé en application de l'accord-cadre.
Enfin, le CEPS relève que le niveau relativement élevé et croissant des remises commerciales accordées par les exploitants de produits génériques constitue le signe d'une rentabilité du secteur. Le comité indique que ces remises étaient en 2021, en moyenne, de 24 % du PFHT, pour un plafond fixé par arrêté ministériel à 40 % par produit447(*). Il précise « cibler pour les baisses les groupes dans lesquels ces remises sont les plus élevées laissant ainsi la possibilité au fabricant de neutraliser ses pertes éventuelles »448(*).
b) Mieux tenir compte de l'intérêt thérapeutique des spécialités matures dans les campagnes de baisse des prix
· Si les baisses de prix intervenant au cours du cycle de vie des médicaments sont légitimes et utiles, cet outil de régulation apparaît, à plusieurs égards, à bout de souffle.
On observe d'abord une réticence croissante du secteur à accepter des baisses de prix, jugées excessives et mal ciblées. Les fabricants de génériques comme les principaux syndicats de pharmaciens ont ainsi refusé, en janvier 2023, de participer aux discussions relatives à la campagne annuelle de baisse de prix qui devaient se tenir, comme chaque année, au sein du comité de suivi des génériques449(*).
Une campagne d'affichage dans les pharmacies, intitulée « Pénurie de médicaments : vous voulez des réponses ? Nous aussi ! » a été lancée concomitamment450(*).
Le contexte inflationniste, et l'augmentation très importante d'autres mécanismes de régulation pesant également sur les médicaments génériques451(*), expliquent partiellement ce regain de tensions. Si le président du CEPS a indiqué à la commission d'enquête « [regretter] ce boycott »452(*) et souhaiter une reprise des travaux, ces facteurs pourraient toutefois durablement durcir les négociations.
Le Gouvernement a finalement annoncé, une semaine seulement après ces événements, un « moratoire sur les baisses de prix des génériques stratégiques sur le plan industriel et sanitaire »453(*), sans préciser quels génériques étaient visés.
· La faiblesse des prix ne constitue pas le facteur principal des pénuries. Les États-Unis et la Suisse, où les prix des produits matures sont beaucoup plus élevés qu'en France, sont ainsi confrontés à des difficultés récurrentes d'approvisionnement. L'Office fédéral de la santé publique suisse faisait ainsi état, en 2022, d'une « forte augmentation du nombre de perturbations de l'approvisionnement » en médicaments454(*).
Toutefois, il faut observer que les interrogations relatives au prix des médicaments génériques sont largement partagées au sein de l'Union européenne. Le ministre allemand de la santé a ainsi annoncé, en décembre 2022, souhaiter augmenter le prix de certains médicaments indispensables, en particulier pédiatriques455(*).
Une mesure de même nature a été récemment décidée aux Pays-Bas.
Le prix des médicaments aux Pays-Bas
Les Pays-Bas font face, comme la France, à une intensification des pénuries de médicaments depuis plusieurs années. Le nombre de médicaments en rupture de stock (c'est-à-dire indisponible depuis plus de deux semaines) y est passé d'environ une centaine en 2004 à plus de 1 500 en 2022, avec une augmentation particulièrement marquée depuis 2012. Le pays serait le deuxième Etat membre le plus touché par le phénomène au sein de l'Union européenne, après le Portugal. Entre 2017 et 2022, plus de 3 300 des 8 000 médicaments génériques commercialisés aux Pays-Bas ne sont plus disponibles.
Plusieurs explications sont avancées pour expliquer cette nette dégradation.
Les prix du médicament aux Pays-Bas ont été contraints à la baisse depuis les années 1990 : ils ont décru de 60 % entre 1996 et 2022. Cette politique s'est d'abord traduite par l'instauration de prix-plafonds en 1996, puis par la réduction des plafonds de remboursement et des prix des médicaments sans brevets, en 2002 et 2004. En 2008, a été mise en oeuvre une « politique préférentielle » pour les assureurs-maladie, qui permet à ces organismes de désigner le médicament qu'ils remboursent parmi ceux ayant la même substance active (le moins cher étant en général retenu). En 2021, les prix-plafonds pour les médicaments ont été à nouveau abaissés.
En réaction à l'accroissement du phénomène de pénurie, le Gouvernement a, en 2023, décidé d'une hausse de 15 % du prix-plafond des médicaments peu rentables (dont le chiffre d'affaires annuel est inférieur ou égal à 500 000 euros), afin d'éviter des arrêts de commercialisation et la disparition de ces références.
Source : Commission d'enquête
· En conséquence, tout en gardant à l'esprit que des pays pratiquant des prix très élevés sont confrontés, eux aussi aux phénomènes de pénuries, il est indispensable de revoir la politique de baisse des prix en tenant mieux compte de l'intérêt thérapeutique et des risques d'approvisionnement attachés à chacun des médicaments visés. Cette priorisation devrait être conduite en cohérence avec les travaux en cours sur l'identification des médicaments essentiels et des médicaments stratégiques d'un point de vue industriel et sanitaire (MSIS).
Le Gouvernement doit donc préciser les orientations transmises au CEPS, qui se limitent aujourd'hui à une instruction à « assurer la sécurité des approvisionnements en produits de santé »456(*). Protéger le prix de médicaments essentiels, ou particulièrement à risque de rupture, constitue un choix politique qui doit être assumé au niveau ministériel.
Enfin, il incombe au Gouvernement de s'assurer que le CEPS dispose des moyens nécessaires - soit directement, soit en bénéficiant de l'appui des administrations centrales participantes -, pour analyser les incidences de ses décisions tarifaires sur la disponibilité des médicaments et l'organisation des chaînes de production. Dans le cas contraire, ceux-ci devraient être renforcés.
Recommandation n° 18 : Revoir les orientations ministérielles transmises au CEPS afin de mieux tenir compte de l'intérêt thérapeutique dans la définition des plans de baisse de prix.
* 387 Article L. 162-16-4 du code de la sécurité sociale.
* 388 Articles L. 162-17-3 du code de la sécurité sociale et D. 162-2-4 du code de la sécurité sociale.
* 389 Article D. 162-2-3 du code de la sécurité sociale.
* 390 Articles L. 162-17-3 et D. 162-2-1 du code de la sécurité sociale.
* 391 Article D. 162-2-5 du code de la sécurité sociale.
* 392 Audition de MM. Philippe Bouyoux, président, et Jean-Patrick Sales, vice-président pour le médicament, du Comité économique des produits de santé, le 28 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230605/ce_penurie.html#toc2
* 393 Ibid.
* 394 Cour des comptes, Rapport sur l'application des lois de financement de la sécurité sociale, septembre 2017, p. 381.
* 395 Article L. 162-17-3 du code de la sécurité sociale : « [Le CEPS] met en oeuvre les orientations qu'il reçoit des ministres compétents, en application de la loi de financement de la sécurité sociale. »
* 396 Article L. 162-17-4-2 du code de la sécurité sociale.
* 397 Article L. 162-16-5 du code de la sécurité sociale.
* 398 Article L. 162-16-6 du code de la sécurité sociale.
* 399 L'article 10 de l'accord-cadre précise les conditions d'application de ce critère : lorsqu'un comparateur est explicitement déterminé dans le libellé de l'ASMR, il est retenu en comparateur ; dans le cas contraire, le comparateur est choisi parmi les comparateurs cliniquement pertinents cités par la CT de la HAS dans son avis.
* 400 Article R. 163-18 du code de la sécurité sociale.
* 401 Article R. 161-71-3 du code de la sécurité sociale.
* 402 Article 65 de la loi n° 2021-1754 du 23 décembre 2021 de financement de la sécurité sociale pour 2022.
* 403 Article R. 163-15 du code de la sécurité sociale.
* 404 Lettre d'orientation ministérielle du 19 février 2021 adressée à M. Philippe Bouyoux, président du CEPS, par Bruno Le Maire, ministre de l'économie, des finances et de la relance, M. Olivier Dussopt, ministre délégué chargé des comptes publics, Agnès Pannier-Runacher, ministre déléguée chargée de l'industrie et Olivier Véran, ministre des solidarités et de la santé.
* 405 Rapport d'activité du CEPS pour 2021, p. 24.
* 406 Rapport d'activité du CEPS pour 2021, p. 27.
* 407 Audition de MM. Philippe Bouyoux, président, et Jean-Patrick Sales, vice-président pour le médicament, du Comité économique des produits de santé, le 28 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230227/ce_penurie.html#toc2
* 408 Lettre d'orientation ministérielle du 19 février 2021 adressée à M. Philippe Bouyoux précitée, p. 1.
* 409 Leem, Bilan économique. Édition 2022, janvier 2023, p. 67
* 410 Aris Angelis et. al., « High drug prices are not justified by industry's spending on research and development », BMJ 2023, 380.
* 411 Audition de Mme Agnès Buzyn, ministre des solidarités et de la santé de 2017 à 2020, le 17 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc8
* 412 Rozenn Le Saint, Chantage sur ordonnance. Comment les labos vident les caisses de la Sécu, mars 2023, p. 56.
* 413 Cour des comptes, Ralfss 2017, p. 378.
* 414 Rapport au ministre chargé de la sécurité sociale et au Parlement sur l'évolution des charges et des produits de l'assurance maladie au titre de 2016, Améliorer la qualité du système de santé et maîtriser les dépenses : propositions de l'assurance maladie pour 2016, juillet 2015, p. 84.
* 415 La tarification des anticancéreux et ses impacts, OMS, janvier 2019, Executive Summary, 13.
* 416 Audition de M. Olivier Véran, ministre des solidarités et de la santé de 2020 à 2022, le 2 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc6
* 417 Rapport annuel du CEPS pour 2021, p. 31.
* 418 Réponses écrites du CEPS au questionnaire transmis par la commission d'enquête.
* 419 Rapport d'activité du CEPS pour 2021, p. 22.
* 420 L'exploitation abusive d'une position dominante est prohibée par l'article L. 420-2 du code de commerce ; le Traité sur le fonctionnement de l'Union européenne (TFUE), en son article 102, interdit l'abus de position dominante, qui peut consister à « imposer de façon directe ou indirecte des prix d'achat ou de vente ou d'autres conditions de transaction non équitables ».
* 421 Le principe de la licence d'office est prévu dans l'ordonnance du 4 février 1959 relative à la réforme du régime de la fabrication des produits pharmaceutiques et à diverses modifications du code de la santé publique, à titre de contrepartie de la création du brevet spécial de médicament, alors que la loi de 1844 alors en vigueur excluait les médicaments de la brevetabilité.
* 422 Articles 37 et 38 de la loi du 2 janvier 1968 sur les brevets d'invention.
* 423 Audition de Mme Catherine Simonin, représentante de France Assos Santé, de Mme Juliana Veras, coordinatrice de Médecins du Monde, du Dr Julie Allemand-Sourrieu, représentante du collectif Santé en danger, du Dr Franck Prouhet, représentant du collectif Notre santé en danger et de M. Christophe Duguet, représentant de l'AFM-Téléthon, le 29 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230327/ce_penurie.html#toc4
* 424 Covid-19 : comment mettre en oeuvre la licence d'office, Elisabeth Berthet, Matthieu Dhenne, Lionel Vial. https://shs.hal.science/halshs-02970543/document
* 425 https://www.elysee.fr/en/emmanuel-macron/2021/05/21/message-from-president-emmanuel-macron-for-the-global-health-summit
On pourrait citer aussi Olivier Véran, alors ministre des solidarités et de la santé, s'exprimant devant le Sénat le 19 mars 2020 à l'occasion des débats sur le projet de loi d'urgence pour faire face à l'épidémie de covid-19 : « Je n'exclus pas de devoir être amené à demander la mise en oeuvre de manière très réactive d'un dispositif de licences d'office ou de plafonnement du prix de médicaments, par exemple. [...] Imaginons que l'efficacité d'un produit expérimenté soit démontrée, qu'il puisse être fabriqué en France, mais que les brevets appartiennent à des entreprises chinoises ou américaines, par exemple. Dans ce cas, la mécanique légistique pour déclencher la production et faire un séquestre afin d'éviter que les médicaments ne sortent du pays est extrêmement complexe. Nous allons perdre du temps. [...] [D]es dispositifs légistiques trop complexes nous feront perdre du temps. »
* 426 Audition de M. Roland Lescure, ministre délégué chargé de l'industrie, le 25 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230522/ce_penurie.html#toc4
Marisol Touraine, ancienne ministre de la santé, a dit aussi son scepticisme, arguant qu'il s'agissait d'un « fusil à un coup ». Audition de Mme Marisol Touraine, ancienne ministre de la santé, le 16 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc2
* 427 En l'espèce, une recherche menée par des équipes de l'Inserm avec le soutien des dons du Téléthon.
* 428 Audition de Mme Catherine Simonin, représentante de France Assos Santé, de Mme Juliana Veras, coordinatrice de Médecins du Monde, du Dr Julie Allemand-Sourrieu, représentante du collectif Santé en danger, du Dr Franck Prouhet, représentant du collectif Notre santé en danger et de M. Christophe Duguet, représentant de l'AFM-Téléthon, le 29 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230327/ce_penurie.html#toc4
* 429 Réponse écrite de l'AFM-Téléthon au questionnaire de la commission.
* 430 https://www.wipo.int/wipolex/fr/text/288516
* 431 Promouvoir l'innovation et l'accès aux technologies de la santé, Rapport du Groupe de haut niveau du secrétaire général des Nations unies sur l'accès aux médicaments, p. 24. Ce rapport mérite d'être cité plus longuement : « La déclaration de Doha a dissipé le mythe selon lequel les licences obligatoires devraient être limitées aux situations d'urgence en confirmant que les membres de l'OMC étaient libres de déterminer les conditions d'octroi des licences obligatoires.
Le principe de licence obligatoire est un élément important de la loi sur les brevets depuis des siècles, et les licences ont été utilisées par les gouvernements de tous les pays pour servir les intérêts de la société ou de l'État, sous réserve de paiement d'une redevance au détenteur des droits. Certains ont exprimé leur inquiétude de voir les licences obligatoires chasser les investisseurs des pays dans lesquels elles sont publiées et craignent que ces gouvernements fassent l'objet de représailles.
Les gouvernements ont utilisé la menace des licences obligatoires pour obtenir des titulaires des brevets qu'ils baissent leurs prix, ces derniers trouvant généralement les prix inférieurs négociés préférables à la perception de redevances. En 2007, après de longues négociations, le gouvernement brésilien a publié une licence obligatoire pour l'efavirenz, un important médicament antirétroviral alors utilisé par un tiers des brésiliens sous traitement via le programme national. Une fois la licence publiée, son prix a baissé, passant de 1,60 USD par dose à 0,45 USD par dose pour la version générique importée du médicament » (Ibid., p. 27).
* 432 Audition de Mme Pauline Londeix et M. Jérôme Martin, co-fondateurs de l'Observatoire de la transparence dans les politiques du médicament (OTMeds), le 5 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230403/ce_penurie.html#toc4
* 433Audition de M. Ayman Sabae, président-directeur général de l'entreprise sociale égyptienne Shamseya, Égypte, le 16 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc5
* 434 En 2013, 11,8 millions de personnes contaminées, soit 14,7 % de la population générale.
* 435 À l'époque, pour l'association sofobusvir-daclatasvir, selon les chiffres disponibles, 300 USD contre 147 000 USD aux États-Unis et 41 000 euros en France pour douze semaines de traitement.
* 436 « Pour certains pays, la mise en place d'une licence d'office implique un affrontement avec des géants pharmaceutiques ayant parfois des chiffres d'affaires supérieurs à leur produit intérieur brut. L'action européenne peut inverser ce rapport de forces. »
Audition de M. Marc Botenga, député européen, le 3 mai https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc9
* 437 Ces clauses sont prévues à l'article L. 162-17-5 du code de la sécurité sociale.
* 438 Article 19 de l'accord-cadre de 2021 : à l'issue d'une période de trois ans pour les ASMR IV et V, de cinq ans pour les ASMR I à III.
* 439 Article L. 162-17-4 du code de la sécurité sociale.
* 440 Article 24 de l'accord-cadre de 2021 conclu entre le CEPS et le Leem.
* 441 Lettre d'orientation ministérielle du 19 février 2021 adressée à M. Philippe Bouyoux précitée, p. 2.
* 442 Audition de représentants des laboratoires et entreprises pharmaceutiques, le mardi 28 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230327/ce_penurie.html#toc2
* 443 Audition de Mme Laure Lechertier, directrice de l'accès au marché, des affaires publiques et de la responsabilité sociale d'entreprise d'UPSA, le 3 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc8
* 444 Audition de MM. Philippe Bouyoux, président, et Jean-Patrick Sales, vice-président pour le médicament, du Comité économique des produits de santé, le 6 juin 2023 : https://www.senat.fr/compte-rendu-commissions/20230605/ce_penurie.html#toc2
* 445 Ibid.
* 446 Article 24 de l'accord-cadre conclu en 2021 entre le CEPS et le Leem.
* 447 Arrêté du 22 août 2014 fixant les plafonds de remises, ristournes et autres avantages commerciaux et financiers assimilés prévus à l'article L. 138-9 du code de la sécurité sociale.
* 448 Réponses écrites du CEPS au questionnaire de la commission d'enquête.
* 449 Les Échos, « Médicaments : clash du secteur face aux baisses de prix imposées aux génériques », 25 janvier 2023.
* 450 L'Express, « Médicaments : vers une baisse des prix ? Les pharmaciens engagent un bras de fer avec l'État », 26 janvier 2023.
* 451 La clause de sauvegarde fait l'objet de développements infra.
* 452 Audition de MM. Philippe Bouyoux, président, et Jean-Patrick Sales, vice-président pour le médicament, du Comité économique des produits de santé, le 6 juin 2023 : https://www.senat.fr/compte-rendu-commissions/20230605/ce_penurie.html#toc2
* 453 Communiqué de presse « Comité de pilotage Médicaments » du 3 février 2023.
* 454 Office fédéral de la santé publique, Pénuries de médicaments à usage humain en Suisse : Analyse de la situation et mesures d'amélioration à examiner, 1er février 2022
* 455 Les Échos, « Pénuries de médicaments : comment l'Allemagne veut sécuriser son approvisionnement », 20 décembre 2022.
* 456 Lettre d'orientation ministérielle du 19 février 2021 adressée à M. Philippe Bouyoux précitée, p. 2.