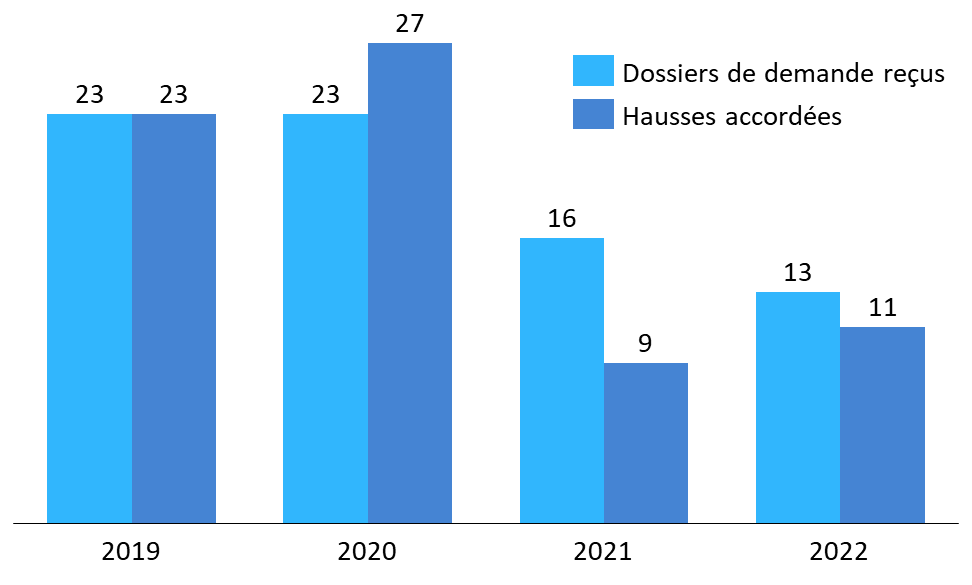B. FAIRE DU PRIX NÉGOCIÉ UN OUTIL DE SÉCURISATION DE L'APPROVISIONNEMENT
1. La difficulté de tenir compte d'une augmentation des coûts
a) La procédure restrictive de hausse des prix prévue par l'accord-cadre
· La forte inflation constatée en 2022 et 2023 a mis en lumière les enjeux entourant la rigidité du prix du médicament qui, administré, ne varie pas au rythme des chocs d'offre ou de demande.
Le Leem, lors de son audition, avait ainsi dressé la liste des coûts croissants dont la rigidité du prix ne permettait pas de tenir compte : « [...] l'explosion des coûts de production, qu'il s'agisse des matières premières, des intrants, des principes actifs, des emballages en verre, en aluminium, en carton, des dérivés du pétrole, de l'énergie, de la masse salariale. Or les médicaments sont des produits à prix administrés : nous n'avons pas la possibilité de répercuter ces augmentations sur le prix des produits, à la différence de la quasi-totalité des autres secteurs. »457(*)
· L'accord-cadre prévoit toutefois un mécanisme permettant au CEPS d'accorder une hausse de prix à certains médicaments particulièrement indispensables à la prise en charge des patientes et des patients, élargi en 2021.
Les hausses de prix (article 28 de l'accord-cadre de 2021)
1. Les conditions d'éligibilité de la demande
L'article 28 de l'accord-cadre de 2021 autorise les entreprises à solliciter une hausse de prix lorsque deux critères cumulatifs sont remplis :
- l'entreprise doit faire état d'un risque important pouvant impacter la production ou la commercialisation d'un médicament ;
- la spécialité concernée répond à un besoin thérapeutique qui ne serait plus couvert au cas où elle disparaîtrait du marché.
Ce second critère est considéré comme rempli lorsque l'avis de la CT de la HAS ne mentionne aucun comparateur remboursé et commercialisé, et lorsque le médicament concerné ne figure pas lui-même comme comparateur d'un produit plus récent.
Ce critère est appliqué de manière plus souple aux antibiotiques : le CEPS analyse alors la couverture du besoin au niveau des DCI, et non des indications.
2. L'obligation de documentation et la définition de la hausse
L'entreprise doit justifier sa demande par la documentation détaillée de la hausse de la matière première ou d'un autre poste concourant aux dépenses d'exploitation.
La hausse de prix accordée se fonde sur le surcoût constaté pour le poste retenu.
3. La possibilité pour le CEPS de se saisir pour un motif de santé publique
Depuis 2021, le CEPS peut, à l'occasion d'une demande de hausse de prix formulée par une entreprise pour un produit qui aurait des concurrents, se saisir pour un motif de santé publique d'une révision de prix de tout ou partie d'une classe thérapeutique.
L'accord-cadre précise que ce dispositif peut notamment servir à « préserver les capacités d'approvisionnement ».
4. L'engagement des entreprises bénéficiaires
Les entreprises bénéficiant d'une hausse de prix doivent s'engager à approvisionner le marché français. À défaut, s'il est démontré que la responsabilité de l'entreprise est en cause dans une rupture d'approvisionnement, le CEPS peut aligner le prix facial HT sur le prix net, à l'issue d'un échange contradictoire avec l'entreprise.
Source : Commission d'enquête
· La procédure de l'article 28 de l'accord-cadre est conçue pour répondre à des demandes individuelles d'entreprises confrontées à un choc de coûts spécifique. Les conditions d'éligibilité `ne sont donc pas adaptées pour répondre à une difficulté macroéconomique telle que l'inflation actuelle.
Le président du CEPS, en audition, a concédé cette limite mais cité, trois exemples d'application à une classe thérapeutique sur décision du comité : « L'article 28 vise des hausses de prix au cas par cas, il n'a pas une portée macroéconomique : son objet n'est pas de permettre des hausses de prix globales pour répondre à l'inflation. Il est toutefois précisé que le CEPS peut procéder à une hausse de prix pour tout ou partie d'une classe thérapeutique [...]. C'est ce que nous avons fait pour les immunoglobulines, à cause des tensions mondiales sur l'offre, pour les héparines à bas poids moléculaire (HBPM), en raison de la hausse des prix des produits dérivés du porc consécutive à l'épidémie de fièvre porcine africaine en Chine, et enfin pour les vaccins antigrippaux. »458(*)
Par ailleurs, les nombres de demandes formulées et d'augmentations tarifaires accordées sont demeurés relativement faibles jusqu'en 2022. Pour les années 2019 à 2022, le CEPS fait état en moyenne d'environ 19 dossiers déposés et 17,5 hausses de prix accordées par an. Identifier les raisons de ce faible recours à cette procédure mériterait un travail approfondi. Les refus prononcés l'ont été du fait de l'existence de produits à même visée thérapeutique inscrits au remboursement459(*).
Nombre de demandes et de décisions de hausse de prix (2019-2022)460(*)
Source : Commission d'enquête, d'après des données CEPS
Le niveau des hausses accordées apparaît très hétérogène : d'après le CEPS, elles s'échelonnaient en 2022 de 1 % à 200 %, et s'élevaient en moyenne à 18 %461(*).
Enfin, si l'accord-cadre prévoit que le CEPS « traitera les demandes de hausses de prix deux fois par an », celui-ci a indiqué ne pas appliquer ces stipulations, selon lui « [inapplicables] dans la situation actuelle d'augmentation des dépôts de demandes ». À cet égard, les délais séparant la transmission de la demande de l'entrée en vigueur de la hausse de prix, intervenant suite à la publication de la décision au Journal officiel, semblent avoir été considérablement réduits par le CEPS depuis 2022462(*).
|
Année |
Délai entre le dépôt du dossier et la publication au JO |
Dont délai entre l'accord du CEPS et la publication au JO |
|
2019 |
104 jours |
20 jours |
|
2020 |
108 jours |
26 jours |
|
2021 |
107 jours |
30 jours |
|
2022 |
30 jours |
8 jours |
Source : Réponses du CEPS au questionnaire transmis par la commission d'enquête
b) Assurer une gestion plus dynamique des prix du médicament
Les stipulations de l'accord-cadre 2021 sont apparues, ces derniers mois, insusceptibles de répondre de manière satisfaisante à la situation de forte inflation.
Le président du CEPS a reconnu, à ce sujet, que « L'application de cet article a suscité des frustrations, voire des critiques, de la part des entreprises : d'une part, parce que certaines demandes étaient déclarées inéligibles et, d'autre part, parce que les hausses de prix que nous accordions étaient inférieures à celles réclamées. »463(*)
· Plusieurs stipulations de l'accord-cadre, inadaptées à la situation, ne sont, en pratique, plus appliquées.
Il en va ainsi de la stipulation relative aux délais d'examen du CEPS, contournée afin de raccourcir les délais de hausse de prix lorsque la demande est justifiée.
Par ailleurs, le Gouvernement a annoncé en février 2023 souhaiter « opérer des hausses de prix ciblées sur certains génériques stratégiques produits en Europe. »464(*) Le président du CEPS a indiqué appliquer, depuis, l'article 28 « avec plus de flexibilité pour déterminer l'éligibilité et en prenant en compte un ensemble plus large de coûts, c'est-à-dire tous les coûts liés à la production, sous réserve qu'ils soient bien documentés »465(*). Le nombre de demandes reçues par le comité a, depuis, fortement augmenté466(*).
· Pour autant, et ainsi que le reconnaît le comité, l'article 28 demeure inadapté pour traiter les cas d'érosion progressive de la rentabilité, aggravée par la période actuelle d'inflation ou l'augmentation de la clause de sauvegarde.
Par ailleurs, la notion de « génériques stratégiques produits en Europe » ne semble recouvrir tout à fait ni celle des médicaments essentiels - qui ne sont pas tous, au demeurant, des génériques - ni celle des médicaments d'intérêt stratégique d'un point de vue industriel et sanitaire (MSIS), dont la liste n'est pas encore finalisée.
· Enfin, le Gouvernement a invité le CEPS à assortir ces hausses de prix dérogatoires d'« engagements des industriels sur une sécurisation de l'approvisionnement du marché français »467(*).
Si la commission d'enquête souscrit à cette idée, elle observe toutefois qu'aucun détail n'a été donné par le Gouvernement sur ses modalités de mise en oeuvre.
Le CEPS, déjà chargé d'appliquer de telles conditions aux hausses de prix classiques qu'il octroie468(*), et pouvant en cas de violation de cet engagement prononcer des baisses de prix, indique que « leur faisabilité interroge car l'impact d'une baisse de prix alors que surviendrait un défaut d'approvisionnement pourrait aggraver les difficultés »469(*). Un dispositif de sanction financière pourrait, de ce point de vue, s'avérer préférable.
· Aussi est-il nécessaire de revoir les modalités de hausse des prix fixées par l'accord-cadre, pour répondre à un triple impératif :
- permettre au CEPS de s'autosaisir d'une hausse de prix, pour une classe thérapeutique, un médicament ou une présentation qu'il jugerait devoir en faire bénéficier ;
- faciliter les hausses de prix sur les médicaments essentiels ou pour lesquels une faible rentabilité favorise l'aggravation des risques d'approvisionnement ;
- assortir ces hausses de prix de conditions tenant à la sécurité d'approvisionnement, sous peine de sanctions financières.
Recommandation n° 19 : Revoir les modalités de hausse de prix fixées par l'accord-cadre pour élargir les capacités d'auto-saisine du CEPS. Faciliter les hausses de prix des médicaments essentiels, à condition d'un engagement des industriels à sécuriser l'approvisionnement.
2. L'opacité de l'économie des médicaments
a) L'opacité du prix des médicaments : la négociation de remises confidentielles
L'opacité entourant l'économie des médicaments tient, d'abord, à la négociation de remises tenues confidentielles, correspondant à des sommes remboursées par l'exploitant à l'Assurance maladie sans venir pour autant réduire le prix facial affiché.
· Les remises constituent un second outil de régulation, largement utilisé par le CEPS pour maîtriser les dépenses de médicaments. Trois types de remises peuvent être distingués.
Les trois types de remises
1. Les remises dites « produits »
L'exploitant et le CEPS peuvent déterminer, par convention, des remises associées à certains produits470(*). Celles-ci peuvent être :
- conditionnées à la réalisation d'une ou plusieurs conditions : accords prix/volume, respect du coût de traitement journalier moyen prévu, plafonnement de la dépense et reversement du chiffre d'affaires au-delà du seuil défini, etc. ;
- ou inconditionnelles : remises « à la première boîte », représentant 64 % du total.
Les remises produits concernent 3 % des produits remboursables dont le prix a été fixé par le CEPS. Ce dernier les limite aux produits innovants ou apportant une innovation mineure (ASMR I à IV). Les remises produits s'élevaient, en 2021, à 4,5 milliards d'euros, soit 92,5 % des remises facturées.
Ces remises présentant, en principe, un « caractère exceptionnel et temporaires », l'accord-cadre prévoit leur transformation, à terme, en baisse pérenne de prix.
2. Les remises d'accès dérogatoire
Des remises peuvent par ailleurs être prévues dans le cadre des procédures d'accès dérogatoire : anciennes autorisations temporaires d'utilisation (ATU), autorisations d'accès précoce471(*), autorisations d'accès compassionnel472(*).
3. Les remises « clause de sauvegarde »
Celles-ci peuvent être versées en règlement de la clause de sauvegarde due par l'entreprise, à condition que celle-ci dispose d'une convention pluriannuelle avec le CEPS473(*).
Source : Commission d'enquête
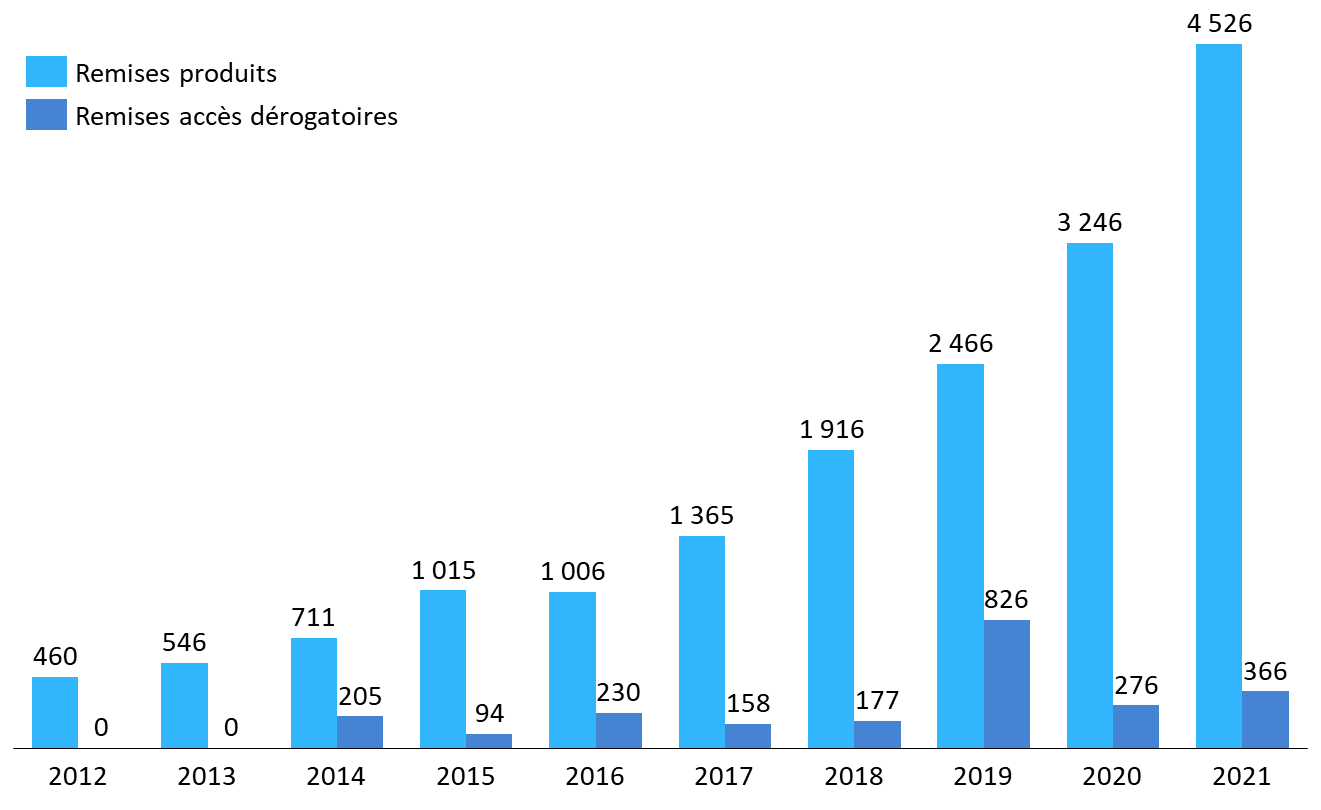
· La très forte croissance des remises et, parmi elles, des remises produits à la première boîte, a pour conséquence de renforcer l'opacité entourant la tarification de l'innovation thérapeutique.
Remises « produits » et « accès dérogatoires » brutes facturées (2012-2021)
(en millions d'euros)
Source : Commission d'enquête, d'après des données CEPS
Cette information revêt pourtant, dans une période de très forte inflation du prix de l'innovation et de déformation des dépenses au profit des spécialités onéreuses, un très grand intérêt pour les citoyennes et les citoyens comme pour les analystes.
Plusieurs personnes auditionnées ont regretté ce manque de transparence. Pauline Londeix, co-fondatrice de l'Observatoire de la transparence dans les politiques du médicament (OT-Meds), a ainsi indiqué à la commission avoir « constaté les conséquences dramatiques de l'opacité de la chaine du médicament. On observe aujourd'hui une problématique d'accès aux données, pour guider les politiques publiques, permettre la prise de décisions éclairées par les élus et alimenter les analyses, y compris des journalistes, sur le sujet. »474(*)
L'OTMeds a d'ailleurs publié, en septembre 2019, une « check-list de la transparence sur les médicaments » énumérant les informations nécessaires à l'information des citoyens. Figurent parmi celles-ci « les termes du contrat (par exemple : toute clause d'exclusivité, durée définie, clause empêchant l'émission d'une licence, etc.) » et « le prix net »475(*).
La check-list entend, ainsi, mettre en application une résolution - non contraignante - adoptée par la soixante-douzième Assemblée mondiale de la santé en mai 2019, qui invitait instamment les États membres « à prendre des mesures appropriées visant à échanger publiquement des informations sur les prix nets des produits sanitaires »476(*).
· Les remises apparaissent comme un outil important de maîtrise des dépenses d'assurance maladie, utilisé par de nombreux États ou systèmes de santé. Toutefois, comment le prix d'un bien aussi essentiel que les médicaments peut-il faire l'objet d'une telle opacité ?
Le Gouvernement et le CEPS doivent rechercher tout moyen soutenable d'améliorer la transparence des prix et de se rapprocher du standard fixé par la convention de l'OMS que la France a soutenue.
b) L'opacité des coûts du médicament : dépenses de recherche et développement, aides publiques et frais de communication
Comme le prix des médicaments innovants, les coûts de recherche, de développement et de commercialisation réellement supportés par les entreprises pharmaceutiques apparaissent largement inconnus du public comme du régulateur.
· Ainsi, aucun des critères légaux de fixation du prix du médicament ne tient compte des coûts de production de celui-ci pour le laboratoire qui l'exploite.
Cette situation présente l'avantage de permettre la fixation du prix du médicament sans dépendre d'informations fournies par l'industriel, qui s'avéreraient difficilement vérifiables. Elle présente, toutefois, l'inconvénient de permettre la rémunération, financée par l'Assurance maladie, d'une innovation thérapeutique à un prix dépassant largement le coût de production.
· Si le prix de l'innovation est fréquemment justifié, également, par les investissements en recherche et en développement nécessaires à sa mise sur le marché, et par la part de risque associée, ces critères ne figurent pas davantage parmi ceux qui justifient la fixation du montant. Ils ne sont pas davantage connus du régulateur.
Cette opacité est d'autant plus regrettable que la part de la recherche publique, voire de la générosité nationale, dans la découverte et le développement d'un médicament peut s'avérer importante, sans parler du crédit d'impôt recherche (CIR), source d'attractivité reconnue de tous, y compris des industriels.
L'exemple du Zolgensma
Le Zolgensma, médicament de thérapie génique permettant de traiter des enfants atteints d'amyotrophie spinale - une maladie mortelle, le plus souvent avant l'âge de deux ans -, constitue ainsi un exemple récurrent. Mis au point avec la contribution du laboratoire de l'AFM-Téléthon, le médicament a toutefois été développé par la biotech américaine Avexis à partir de 2013, finalement rachetée par Novartis.
L'AFM-Téléthon indique avoir octroyé à AveXis une licence lui permettant d'utiliser leurs technologies, constatant ne pas disposer « des moyens financiers pour mener ces essais [cliniques] »477(*). Malgré la contribution déterminante de l'association à son développement, le médicament est vendu à un prix record de près d'1,9 million d'euros.
À ce sujet, l'OTMeds a déclaré devant la commission d'enquête : « La thérapie innovante apportée par le Zolgensma, par exemple, a été découverte grâce à l'argent public de l'Inserm et aux dons défiscalisés au Téléthon. Or cette thérapie est aujourd'hui vendue pour deux millions d'euros, avec des tirages au sort organisés en Belgique où elle n'est pas remboursée. La transparence nécessiterait d'être assurée sur les éléments justifiant ce prix (coûts de production, montant réel des aides publiques, etc.) et l'attribution d'un brevet. »478(*)
Source : Commission d'enquête
Si le législateur, en 2019, a entendu renforcer la transparence en la matière en contraignant les entreprises à mettre à la disposition du CEPS « le montant des investissements publics de recherche et développement dont elles ont bénéficié pour le développement des médicaments inscrits ou ayant vocation à être inscrits » au remboursement, et en précisant que « Ce montant est rendu public »479(*), ces dispositions n'ont toutefois pas eu l'effet espéré.
Lors de son audition, le CEPS a en effet précisé le périmètre restreint des informations attendues, et indiqué que le CEPS ne serait pas en mesure de les contrôler : « En réalité, ce ne sont pas des aides, mais des investissements publics. Le CIR n'en fait pas partie. S'il s'agissait d'aides publiques, le périmètre serait plus large. C'était la première année que nous recevions des informations sur ces investissements et, effectivement, nous n'avons pas reçu toutes les réponses attendues des entreprises conventionnées avec nous. Nous les relançons, mais nous n'avons ni la compétence ni les moyens humains d'expertiser. »480(*)
* 457 Audition de représentants des laboratoires et entreprises pharmaceutiques, le mardi 28 mars 2023 : https://www.senat.fr/compte-rendu-commissions/20230327/ce_penurie.html#toc2
* 458 Audition de MM. Philippe Bouyoux, président, et Jean-Patrick Sales, vice-président pour le médicament, du Comité économique des produits de santé, le 28 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230605/ce_penurie.html#toc2
* 459 Réponses écrites du CEPS au questionnaire transmis par la commission d'enquête.
* 460 Un dossier reçu en année n peut être traité en année n+1. C'est la raison pour laquelle le nombre de hausses accordées en 2020 est supérieur au nombre de demandes reçues la même année.
* 461 Réponses écrites du CEPS au questionnaire transmis par la commission d'enquête.
* 462 Ibid.
* 463 Audition de MM. Philippe Bouyoux, président, et Jean-Patrick Sales, vice-président pour le médicament, du Comité économique des produits de santé, le 28 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230605/ce_penurie.html#toc2
* 464 Communiqué de presse « Comité de pilotage Médicaments » du 3 février 2023.
* 465 Audition de MM. Philippe Bouyoux, président, et Jean-Patrick Sales, vice-président pour le médicament, du Comité économique des produits de santé, le 28 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230605/ce_penurie.html#toc2
* 466 Le CEPS indique avoir reçu, entre mi-février et mi-juin 2023, 45 demandes et avoir traité, sur la même période, 33 dossiers de hausse de prix. Parmi ces derniers, seuls 11 dossiers ont été qualifiés d'éligibles.
* 467 Communiqué de presse « Comité de pilotage Médicaments » du 3 février 2023.
* 468 L'article 28 de l'accord-cadre prévoit que les hausses de prix s'accompagnent « d'un engagement de l'entreprise à approvisionner le marché français. » Voir supra.
* 469 Réponses écrites du CEPS au questionnaire transmis par la commission d'enquête.
* 470 Article L. 162-18 du code de la sécurité sociale.
* 471 Article L. 162-16-5-1-1 du code de la sécurité sociale.
* 472 Article L. 162-16-5-2 du code de la sécurité sociale.
* 473 Article L. 138-13 du code de la sécurité sociale.
* 474 Audition de Mme Pauline Londeix et M. Jérôme Martin, co-fondateurs de l'Observatoire de la transparence dans les politiques du médicament, le 5 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230403/ce_penurie.html#toc3
* 475 OTMeds, Check-list de la transparence sur les médicaments, 1er septembre 2019.
* 476 Résolution de l'Assemblée mondiale de la santé « Améliorer la transparence des marchés de médicaments, de vaccins et d'autres produits sanitaires » du 28 mai 2019.
* 477 AFM-Téléthon, « La thérapie génique Zolgensma : précision sur son prix et le rôle joué par Généthon », 19 octobre 2022.
* 478 Audition de Mme Pauline Londeix et M. Jérôme Martin, co-fondateurs de l'Observatoire de la transparence dans les politiques du médicament, le 5 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230403/ce_penurie.html#toc3
* 479 Article 79 de la loi n° 2020-1576 du 14 décembre 2020 de financement de la sécurité sociale pour 2021.
* 480 Audition de MM. Philippe Bouyoux, président, et Jean-Patrick Sales, vice-président pour le médicament, du Comité économique des produits de santé, le 28 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230605/ce_penurie.html#toc2