B. CONFORTER LES RELOCALISATIONS PAR DES AIDES CIBLÉES ET CONDITIONNÉES
1. Établir une stratégie de relocalisation ciblée sur les médicaments critiques d'un point de vue thérapeutique et industriel
a) Des aides à la réindustrialisation pharmaceutique en France qui se sont multiplié depuis la pandémie de la covid-19
La délocalisation progressive de certains maillons de la chaîne de production du médicament en dehors de l'Europe, en particulier les principes actifs et les médicaments matures, ne pourra pas être inversée sans action volontariste des pouvoirs publics et des industriels.
D'une part, les investissements nécessaires sont très lourds et se comptent, pour chaque site, en dizaines, voire centaines de millions d'euros. Ils impliquent la réimplantation, sur le territoire de l'Union européenne, d'activités parfois mal comprises et mal perçues par les citoyennes et citoyens européens, notamment celles du secteur de la chimie. D'autre part, les facteurs économiques qui avaient conduit les exploitants européens à délocaliser persistent : différentiel de compétitivité et de réglementation environnementale avec les producteurs asiatiques, visibilité réduite sur la régulation et la rentabilité du secteur à moyen-terme, forte pression sur la dépense de santé pesant en faveur de la concentration de la filière notamment.
La feuille de route présentée par le Gouvernement en 2019 comportait l'objectif d'ordre général consistant à « proposer des solutions innovantes et des mesures d'incitations fiscales au maintien/à la relocalisation de sites de production en Europe », à horizon 2022.
Il a cependant fallu qu'intervienne la crise liée à la pandémie de la covid-19, qui a apporté la nouvelle preuve de la dépendance de la France en matière de médicaments, pour que le Gouvernement mette enfin en oeuvre cette politique volontariste de réindustrialisation pharmaceutique. De l'aveu même de la DGE, « avant la crise de la covid-19, l'action de la DGE était plutôt centrée sur l'innovation, avec notamment pour objectif de positionner la France en leader en matière de biothérapies et de bioproduction de ces thérapies innovantes. La crise de la covid-19 a donné lieu à une prise de conscience collective de notre forte dépendance industrielle, ce qui nous a conduits à nous positionner plus fortement sur ces enjeux de souveraineté industrielle. »644(*) D'ailleurs, les premiers travaux de la filière Industries de santé, en 2019, se concentraient davantage sur l'accroissement des exportations de médicaments, que sur l'approvisionnement des besoins français de médicaments.
Dans le contexte de la pandémie, le 18 juin 2020, un appel à manifestation d'intérêt dénommé « Capacity building », financé par le Programme d'investissements d'avenir, a soutenu 51 projets, pour des montants d'aides allant de 460 000 euros à 42 millions d'euros et un total d'environ 625 millions d'euros. Les projets concernés devaient être directement liées aux besoins de traitement de la pandémie, notamment par la production de vaccins ou de médicaments utilisés dans le traitement des symptômes du SARS-CoV-2.
Le plan France Relance a également financé des investissements dans les secteurs stratégiques, non limités à celui de la santé, par le biais de l'appel à projets « Résilience ». 55 projets du secteur pharmaceutique ont été soutenus dans ce cadre, pour un montant total de 66 millions d'euros environ, avec des aides allant 92 000 euros à 5 millions d'euros.
Selon la DGE, pour ces deux enveloppes, « nous estimons qu'environ 10 % des projets soutenus sont actuellement achevés. La durée de ces projets, qui comportent souvent une phase de R&D en amont de la phase d'industrialisation, est en majorité de l'ordre de trois à quatre ans, ou de cinq ans maximum. »645(*)
Enfin, financée par France 2030 et le plan Innovation Santé 2030, une troisième enveloppe sera mobilisée dans le cadre d'un appel à projets « Capacités et industrialisation 2030 », concernant les projets d'industrialisation dans trois thématiques spécifiques de santé. Sont ainsi prévus 250 millions d'euros pour les biothérapies et la bioproduction de thérapies innovantes, 300 millions d'euros pour les maladies infectieuses émergentes et les menaces nucléaire, radiologique, biologique et chimique (NRBC) et 140 millions d'euros pour les dispositifs médicaux et de diagnostic in vitro. À date, quinze projets auraient été accompagnés, pour un montant total d'aides de 62 millions d'euros, selon la DGE.
b) Une stratégie de relocalisation non clairement établie
S'il est indéniable que la prise de conscience liée au choc de la covid-19 a enfin entraîné une action des pouvoirs publics en faveur de la reconstruction de capacités de production de médicaments, ces efforts de soutien apparaissent néanmoins diffus et brouillons.
La consultation de la liste des projets lauréats des différents appels à projets ou à manifestation d'intérêt appelle plusieurs remarques :
- tout d'abord, disposer de chiffres et d'informations fiables sur les bénéficiaires et les finalités des aides publiques accordées dans le cadre du plan de Relance et de France 2030 est difficile. La DGE, l'Agence pour l'innovation en santé, la ministre Pannier-Runacher et le ministre Lescure ont cité des chiffres différents concernant à la fois le nombre de bénéficiaires et le montant total des aides ;
- un nombre conséquent de projets concernaient des dispositifs médicaux ou des composants (aiguilles, poches, seringues, flacons...), plutôt que des médicaments ou principes actifs pharmaceutiques, ce qui tend à nuancer le volume d'aides réellement dirigé vers la relocalisation de capacités de production de médicaments ;
- c'est souvent l'extension ou le renforcement de capacités préexistantes qui était visé, plutôt que la création de capacités nouvelles sur le sol français ;
- dans certains cas, l'objectif des projets financés, bien que légitime, présentait un lien pour le moins distant avec la relocalisation, visant par exemple à l'installation de plateformes de contrôle qualité sur des sites existants ou la rénovation de systèmes informatiques en place. Ainsi, pour l'un des projets, l'objectif affiché, évasif et très général, était de « rester compétitif » et de « pérenniser l'activité » ;
- y compris pour les projets de relocalisation, le champ de certains financements, tel que prévu dans leurs cahier des charges, apparaît particulièrement large. L'AMI Capacity building par exemple visait, selon son cahier des charges : « les médicaments d'intérêt thérapeutique majeur (MITM) et principes actifs entrant dans leur formulation », soit environ 6 000 médicaments et l'ensemble de leurs principes actifs.
On peut donc légitimement s'interroger sur la finalité réelle de ces aides publiques, qui semblent avoir plutôt relevé d'un soutien à la compétitivité et à l'innovation des entreprises implantées en France, que d'un effort ciblé de financement de création de nouvelles capacités productives.
Au total, peu de projets ont réellement conduit à réimplanter en France la production d'un médicament qui n'y était plus fabriqué. Selon la DGE, sur 106 projets financés par l'AAP Résilience et l'AMI Capacity building, seuls 18, soit 17 %, ont réellement concerné une relocalisation. C'est notamment le cas du projet de l'entreprise Seqens, visant à relocaliser la production de paracétamol, sachant toutefois que certaines matières premières nécessaires à sa fabrication resteront produites en Chine. Parmi ces 18 projets, seuls cinq concernaient la relocalisation de médicaments stratégiques646(*).
De l'aveu de Lise Alter, directrice générale de l'Agence de l'innovation en santé, de plus, « France 2030 n'a pas spécifiquement vocation à financer des capacités de production pour des molécules en tension d'approvisionnement »647(*), sa finalité première étant de stimuler et financer l'innovation. En dehors des cas dans lesquels il existe une possibilité de relocaliser en s'appuyant sur des procédés de production innovants, il semble donc que les dispositifs d'aides publiques au secteur pharmaceutique ne soient pas initialement conçus pour stimuler la production de médicaments matures à risque de tensions d'approvisionnement.
L'audition des représentants de la direction générale des entreprises a confirmé le manque de conception stratégique des enveloppes de soutien à l'industrie pharmaceutique mobilisées depuis 2020 : c'est seulement « une fois passée l'urgence du contexte de relance post-covid-19 » que le Gouvernement a perçu la nécessité de « structurer une approche méthodologique afin de cibler les investissements en faveur de la relocalisation de productions de médicaments. Cela s'est traduit dans l'avenant au contrat stratégique de filière de juin 2021, à l'occasion duquel une extension de son périmètre à une plus grande part de la chaîne de valeur des industries de santé a été décidée. La crise a en effet montré l'existence de l'urgence à assurer la résilience de notre industrie de santé en matière d'approvisionnement en principes actifs. »648(*) Au contrat stratégique de filière (CSF) des industries de santé a alors été ajoutée en 2021 une action « Relocalisation de principes actifs intermédiaires ou médicaments essentiels », ayant abouti à une étude sur la vulnérabilité des chaînes de valeur. Ces efforts apparaissent bien tardifs, alors que le Sénat avait souligné cette nécessité dès 2018.
L'évaluation de ces aides est, pour l'instant, quasi inexistante, la DGE indiquant qu'« un grand nombre de projets soutenus n'étant pas encore terminés, un bilan [...] ne pourra être mené que d'ici quelques années ». Plusieurs contrôles devraient néanmoins être lancés en 2023, tant en interne que par des organismes extérieurs, notamment France Stratégie et la Cour de comptes649(*).
Afin d'éviter le saupoudrage alors que l'effort financier public est conséquent - près d'1,4 milliard d'euros de soutien ayant déjà été avancé ou annoncé - et les tâtonnements des précédents dispositifs, il est avant tout impératif d'établir rapidement une stratégie claire de relocalisation, puis de concentrer le soutien public sur les actions à plus fort impact en imposant des conditionnalités.
Cette stratégie de relocalisation doit être conçue en trois étapes :
· premièrement, l'élaboration d'une liste de médicaments critiques, plus ciblée que la liste des MITM qui s'avère trop large et trop peu étayée pour être pertinente. Celle-ci doit se faire en tenant compte d'une perspective thérapeutique - le caractère particulièrement essentiel au système de santé - et d'une vulnérabilité concernant l'approvisionnement. Il convient notamment d'examiner la source de la vulnérabilité et l'étape de production concernée.
Cette liste ne doit pas se borner à identifier les médicaments essentiels, mais aussi ceux de leurs composants qui doivent faire l'objet d'une attention particulière. Comme l'a expliqué le SICOS, « avoir une liste permettant de passer de 4 000 médicaments d'intérêt thérapeutique majeur à 200 ou 300 molécules sur lesquelles concentrer notre travail est important pour nous, compte tenu de l'intensité concurrentielle sur ces produits et du temps de développement - presque trois ans - d'une molécule. [...] La réindustrialisation est nécessaire, nous y sommes très favorables, mais elle ne pourra se faire que sur un périmètre bien défini. »650(*)
· deuxièmement, l'examen, pour chacun de ces médicaments, de la faisabilité de la relocalisation des étapes de production vulnérables, qu'il s'agisse du produit fini ou du principe actif. Il faut en effet s'assurer de la disponibilité des matières premières, dont l'essentiel est aujourd'hui produit en Chine, ou de la technologie ;
· troisièmement, l'examen des conditions indispensables au succès de cette relocalisation, en termes de structuration de la chaîne de valeur mais surtout de perspectives de marché et de rentabilité.
Le Gouvernement semble, depuis le début des investigations de la commission d'enquête, s'être engagé en ce sens. L'élaboration d'une liste resserrée de 454 médicaments critiques a été menée à bien au mois de juin dernier651(*). Le 13 juin, le Président de la République a annoncé un plan de relocalisation de la production de médicaments en France. Parmi la liste de médicaments critiques, « une cinquantaine de médicaments essentiels pour lesquels notre dépendance aux importations extra-européennes est avérée » devrait être relocalisée.
Huit projets de relocalisations déjà décidés ont été annoncés par le Président - certaines des entreprises concernées ayant déjà fait l'objet de financements dans le cadre des précédents dispositifs d'aide -, tandis que vingt-cinq autres projets devraient rapidement faire l'objet d'un « guichet » de financement à hauteur de 50 millions d'euros, prélevés sur l'enveloppe de France 2030652(*).
Dossier de presse du « plan de relocalisation » annoncé par le Président de la République le 13 juin 2023
« Afin de prioriser nos efforts de relocalisation, nous avons identifié les médicaments essentiels sur lesquels nous sommes les plus dépendants des importations extra-européennes, soit une cinquantaine à ce stade. Parmi ces médicaments : le paracétamol, des antibiotiques comme l'amoxicilline, des anticancéreux, des médicaments utilisés pour la réanimation et l'urgence ou bien des médicaments nécessaires à la prise en charge des affections chroniques, comme l'insuline rapide.
Ce que nous annonçons aujourd'hui est majeur : sur cette cinquantaine de médicaments, la moitié verra sa production relocalisée ou augmentée significativement sur le territoire national d'ici cinq ans. Et cela grâce aux projets soutenus depuis 2020 dans le cadre des actions du Gouvernement ainsi qu'aux huit nouveaux projets de relocalisation annoncés aujourd'hui. Interor investit à Calais (Hauts-de-France), Seqens sur plusieurs sites d'Ile-de-France, EuroAPI à Vertolaye (Auvergne-Rhône-Alpes), Aguettant à Lyon (Auvergne-Rhône-Alpes), Skyepharma à Saint-Quentin-Fallavier (Auvergne-Rhône-Alpes), Ethypharm à Grand-Quevilly (Normandie), GSK à Mayenne (Pays de la Loire) et Benta Lyon à Saint-Genis-Laval (Auvergne-Rhône-Alpes).
Afin d'amplifier encore davantage cette dynamique, un nouveau guichet dédié à la relocalisation des médicaments essentiels sera lancé, dans le cadre de France 2030, dans les prochains jours. Je sais les industriels très mobilisés sur ces sujets et je les appelle donc à se saisir de ce dispositif. » (Roland Lescure)
Source : Dossier de presse du Gouvernement653(*)
La troisième condition, relative à la pérennité de la relocalisation, doit être sérieusement considérée. Elle implique d'assurer, notamment, la rentabilité à long terme de l'activité ainsi implantée.
Carelide fait office, à cet égard, de parfait contre-exemple. L'entreprise française, implantée dans le Nord, fabriquant des solutions pour poches à perfusion, a été soutenue en 2020 et 2021 à hauteur de plus de cinq millions d'euros de subventions dans le cadre du plan de Relance et de France 2030 (notamment l'AMI Capacity building), en vue de renforcer sa capacité productive. Toutefois, en janvier 2023, l'entreprise a été placée en redressement judiciaire. Bien que la reprise de l'entreprise par deux laboratoires implantés en France ait depuis été annoncée, cette évolution défavorable traduit l'impréparation et le manque d'anticipation des pouvoirs publics : l'enjeu de compétitivité de l'activité d'une part, notamment face aux concurrents asiatiques, et de visibilité sur les commandes, de l'autre, auraient dû être mieux appréhendés. Selon les informations recueillies par la commission d'enquête, en particulier, les acheteurs publics ont continué, pour des raisons budgétaires, à recourir à des concurrents de Carelide situés à l'étranger, problème qu'une étude approfondie aurait dû détecter. Après la fermeture de la filière française de masques constituée dans l'urgence lors de la pandémie, Carelide vient rappeler qu'une politique de réindustrialisation ne peut se faire sans garantie de débouchés sur la durée.
Des aides inutiles faute de « bouclage » par l'achat public : l'exemple de Carelide
L'exemple de Carelide, dernier fabricant français de poches de perfusion de paracétamol à destination des hôpitaux, installé sur le site de Mouvaux (Nord), offre de ce point de vue un exemple éclairant : malgré l'octroi par l'État, en octobre 2020, dans le cadre de l'appel à manifestation d'intérêt Capacity Building, d'une aide de 5,1 millions d'euros visant à soutenir un plan d'investissement de 12,5 millions d'euros, l'entreprise a été placée en redressement judiciaire le 24 octobre 2022, de nombreux acteurs imputant cet échec à un déficit de compétitivité face à la concurrence d'autres fabricants mieux placés, car moins chers, pour remporter les marchés des hôpitaux français, lesquels n'effectuaient auprès de Carelide que 30 % de leurs achats. Comme l'a déclaré M. Nicolas Dufourcq, directeur général de BpiFrance, la modernisation de l'outil de production, censée « répondre à l'objectif de pérennisation de la capacité de production française de médicaments critiques », « n'a pas suffi, car les prix des appels d'offres des centrales d'achat ont encore baissé »654(*).
Si une solution a finalement pu être trouvée, le tribunal de commerce de Lille validant en février 2023 l'offre de reprise émanant des laboratoires Delpharm et Aguettant, soutenue par l'État à hauteur de 20 millions d'euros de prêt et de 5 millions d'euros de subventions, la viabilité à long terme de tels investissements dépendra de la mobilisation d'une véritable politique d'achat souverain.
Source : Commission d'enquête
De plus, cette stratégie doit impérativement se concevoir en coordination avec l'échelon européen. D'une part, les perspectives offertes par le marché européen (en volume de ventes) sont indispensables pour assurer la pérennité et la rentabilité des sites de production « relocalisés ». D'autre part, pour éviter la redondance des aides publiques, et donc leur gaspillage, il faut coordonner le soutien aux industriels pharmaceutiques entre pays et favoriser les projets de dimension européenne. Enfin, le nombre de médicaments essentiels rend impossible la relocalisation complète de l'ensemble des chaînes de valeur concernées. Selon l'ANSM, en particulier, « la maille européenne est à travailler pour les médicaments anciens hors brevet, la demande regroupée à l'échelle continentale inciterait à la production, et il faudrait veiller à ne pas être en mono-site ni en monoproduction »655(*).
Recommandation n° 29 : Établir une stratégie claire et transparente de relocalisation, en France et en Europe, de la production de médicaments critiques.
2. Conditionner les aides versées et contrôler leur réalisation
Le niveau élevé de soutien public à la production de médicaments doit s'accompagner de contreparties claires, cohérentes avec l'objectif de souveraineté sanitaire et industrielle qui justifie ces aides.
a) Le secteur pharmaceutique, un bénéficiaire important d'aides publiques et d'incitations fiscales
Depuis plusieurs décennies, le secteur pharmaceutique est l'un des principaux bénéficiaires d'incitations fiscales et d'aides publiques en France.
(1) Le crédit impôt recherche bénéficie largement au secteur pharmaceutique
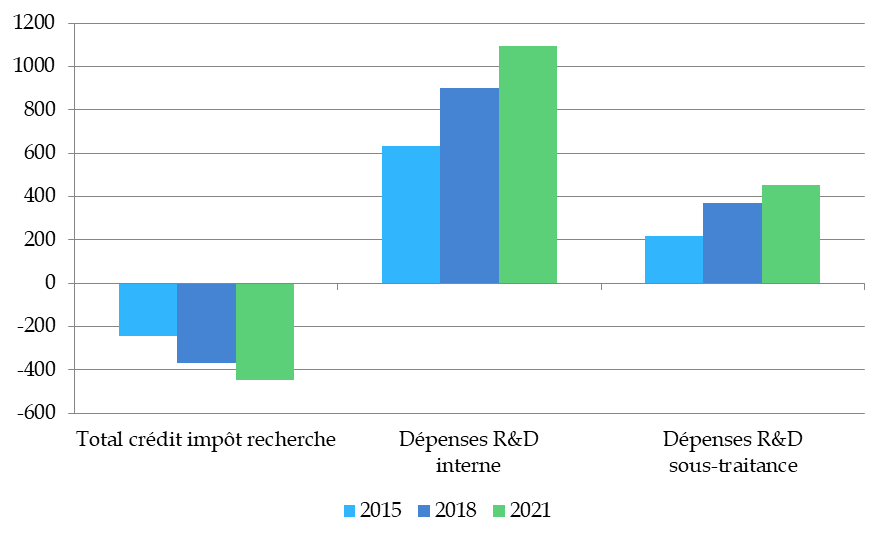
Au premier rang de celles-ci figure le crédit impôt recherche (CIR). En 2020, le secteur pharmaceutique a bénéficié de près de 710 millions d'euros de crédit d'impôt au titre de ses dépenses de recherche, internes comme sous-traitées, dans les conditions prévues par la loi. Le secteur est ainsi le second bénéficiaire du CIR au sein de l'industrie manufacturière, après les industries électriques et électroniques et représente 10 % du montant total de CIR656(*).
Par ce dispositif, environ un tiers des dépenses engagées en faveur de la R&D sont ainsi déduites de l'imposition due par l'entreprise, principalement au titre de l'impôt sur les sociétés. Le poids relatif du CIR dans la fiscalité de l'industrie pharmaceutique a augmenté au cours des cinq dernières années. Alors que le CIR représentait environ 19 % de l'impôt dû657(*) par les entreprises du secteur en 2015, il représente 34 % en 2021, soit le tiers. Cette tendance à la réduction du taux implicite d'imposition sur les sociétés est confirmée par l'évaluation du crédit d'impôt recherche réalisée par la commission nationale d'évaluation des politiques d'innovation (CNEPI) en 2021658(*).
Évolution du poids du CIR par rapport aux dépenses de recherche en 2015, 2018 et 2021
(en millions d'euros)
Source : Commission d'enquête, sur données DGFiP, réponses au questionnaire
Poids du CIR par taille d'entreprise
|
Nombre d'entreprises |
Montant total CIR (millions d'euros) |
|||||
|
2015 |
2018 |
2021 |
2015 |
2018 |
2021 |
|
|
TPE |
164 |
210 |
215 |
17,5 |
27,6 |
33,1 |
|
PME |
140 |
196 |
225 |
101,3 |
155,7 |
181,6 |
|
ETI |
25 |
47 |
71 |
90,9 |
149,8 |
197,4 |
|
GE |
2 |
2 |
2 |
34,3 |
36,2 |
34,3 |
|
Ensemble |
331 |
455 |
513 |
244,0 |
369,4 |
446,4 |
Source : DGFiP, réponses au questionnaire de la commission d'enquête
Autour de 10 % des crédits d'impôt totaux consentis au secteur via le CIR, soit autour de 35 millions d'euros, concernent les deux principales entreprises françaises de l'industrie du médicament (ce chiffre ne prenant pas en compte les différentes filiales des grands groupes). À l'inverse, les TPE-PME, qui représentent environ 86 % des entreprises du secteur, ne représentent que la moitié du montant total du CIR environ. Or, comme l'a déjà souligné le rapport d'information du Sénat intitulé « Transformer l'essai de l'innovation : un impératif pour réindustrialiser la France »659(*), présenté en juin 2022, l'effet d'entraînement réel du CIR est bien supérieur dans les petites entreprises qu'au sein des grandes entreprises, pour lesquelles il existe un effet d'aubaine documenté.
(2) Une contribution importante de la recherche publique
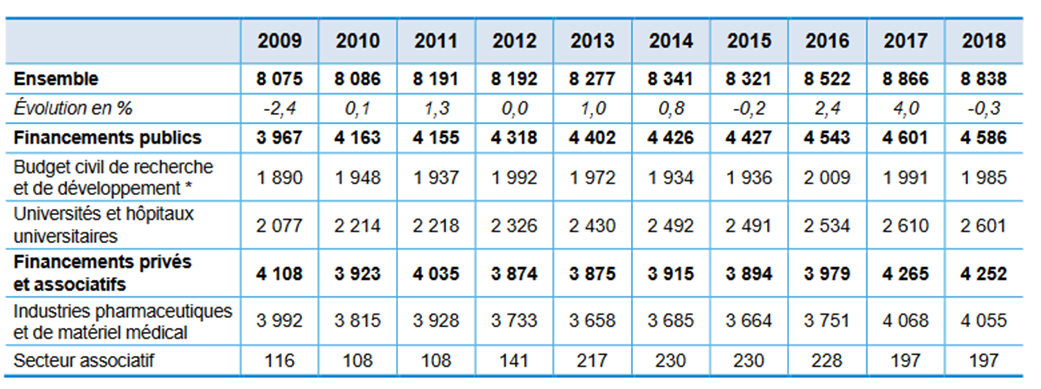
En dehors du seul CIR, les industriels bénéficient très largement de l'effort public en faveur de la recherche fondamentale. Selon un rapport de France stratégie, les organismes publics portent aujourd'hui plus de la moitié de la dépense totale de recherche et de développement dans l'industrie pharmaceutique, à hauteur de près de 4,6 milliards d'euros par an au sein des organismes de recherche financés sur le budget civil et de la recherche universitaire. Les entreprises pharmaceutiques dépensent, elles, environ quatre milliards d'euros par an en R&D660(*). Par ailleurs, le secteur associatif (notamment la Ligue contre le cancer et l'AFM-Téléthon) contribue, chaque année, à hauteur d'environ 200 millions d'euros à la recherche médicale et pharmaceutique.
Évolution des dépenses de R&D privées et publiques dans l'industrie de la santé entre 2009 et 2018
(en millions d'euros)
Source : France stratégie
(3) Un soutien à l'investissement et à l'innovation par Bpifrance et des dispositifs ponctuels financés par le budget de l'État
Afin de préciser les différentes modalités de soutien public à l'innovation et à l'investissement dans l'industrie pharmaceutique, la commission d'enquête a également entendu Bpifrance,. Selon l'établissement, « ce modèle [...] est fondé sur le partage de la prise de risque en innovation en santé entre la puissance publique et les capitaux privés ». et s'appuie sur trois outils principaux : des subventions, accordées définitivement ; des avances remboursables, que l'entreprise rembourse « en cas de succès sur une durée raisonnable » ; et des entrées au capital, soit directement de Bpifrance, soit de fonds privés financés par Bpifrance. L'établissement octroie également des prêts bancaires.
Enfin, comme évoqué plus haut, la multiplication de dispositifs de soutien à la réindustrialisation, la relocalisation et l'innovation, dans le cadre du plan de Relance et de France 2030, est venue augmenter de manière conséquente l'effort de financement des établissements pharmaceutiques depuis 2020.
b) Des aides trop peu ciblées, encadrées et évaluées
Comme l'a souligné Marisol Touraine, « contrairement à ce que l'on entend, l'activité de R&D dans l'industrie pharmaceutique bénéficie de fonds publics importants [...] Il y a un engagement financier public majeur, y compris aux États-Unis [...] ».
Pourtant, ces aides n'ont pas empêché les délocalisations ni les fermetures de site.
Le cas d'Axyntis
L'entreprise Axyntis a bénéficié d'importantes aides publiques à la recherche et développement et à la réindustrialisation au cours des dernières années, notamment au titre des programmes d'investissement d'avenir (PIA) à hauteur de trois millions d'euros environ, d'aides de la Région Hauts-de-France pour 800 000 euros environ, et d'une aide du ministère de l'Économie représentant un million d'euros. Elle a été lauréate de l'AMI Capacity building.
Pourtant, l'entreprise a annoncé fermer son site de Calais, qui compte 120 salariés et a été mis en liquidation judiciaire par le tribunal de commerce d'Orléans début mai 2023. Selon David Simmonet, entendu par la commission d'enquête : « aujourd'hui, force est de constater qu'il n'est guère possible de relocaliser en France des productions de molécules à très forts volumes. [...] La stratégie que nous avons mise en oeuvre est donc un échec ». L'entreprise indique avoir investi près de 26 millions d'euros dans le site depuis sa reprise en 2013, sans avoir pu renouer avec la profitabilité.
L'entreprise explique ces difficultés par plusieurs aléas logistiques, par la concurrence d'une entreprise belge et l'échec de deux projets de R&D structurants, ayant maintenu le site en sous-production. C'est pourtant « après avoir fait constater ces difficultés » qu'Axyntis a bénéficié des financements de la Région et du ministère de l'Économie.
Selon l'entreprise, « les aides perçues dans le cadre de l'AMI prennent la forme de prêts, qui devront être remboursés ». La commission d'enquête ne dispose pas d'informations sur la conditionnalité attachée aux autres aides perçues avant la décision de fermeture du site de Calais. Selon certains observateurs, les aides auraient finalement permis à Axyntis de renforcer son outil industriel à Pithiviers, autre site du groupe, en sacrifiant le site Synthexim de Calais.
Source : Commission d'enquête
Elles ne se sont pas non plus traduites par un « retour sur investissement » significatif pour la collectivité au titre de sa dépense publique, le prix des médicaments innovants étant en forte croissance et pesant sur le budget de la sécurité sociale.
Dans le même temps, la profitabilité du secteur pharmaceutique s'est maintenue, voire accrue, comme l'a rappelé Bpifrance : « Il s'agit, depuis le milieu des années 1990, de l'une des classes d'actifs les plus risquées, mais aussi les plus profitables : une fois sur dix, le succès est gigantesque. Toutes les cohortes de performance des fonds de capital-risque français, et même européens, réalisées depuis 1995, montrent que la biotech est plus profitable que le venture capital digital. C'est ainsi que les performances des fonds de biotech français, et notamment parisiens, sont supérieures à ceux du secteur digital californien. »
Le partage du risque et des coûts entre État et industriels est évident ; à l'inverse, le partage des bénéfices l'est beaucoup moins. Comme l'a exprimé OTMeds devant la commission, « un brevet est censé récompenser une prise de risque et un investissement. Cependant, si la prise de risque et l'investissement ont été considérablement absorbés par le public, un brevet est-il légitime ? Dans pareils cas, comment justifier que l'on paie deux fois les médicaments ? »661(*). Lors des auditions de la commission d'enquête, le cas du Zolgensma a souvent été cité. Comme on l'a vu, la recherche de l'Inserm et les dons collectés dans le cadre du Téléthon ont contribué à financer la création de ce traitement de thérapie génique contre l'amyotrophie spinale, désormais vendu à près de deux millions d'euros par son fabricant, sans aucun « retour sur investissement » pour la puissance publique.
Il est donc légitime de s'interroger sur le réel « service rendu » des aides publiques662(*) à l'industrie pharmaceutique, y compris lorsqu'elles interviennent en faveur d'un objectif de politique publique louable tel que la relocalisation de la production de médicaments.
c) Des aides trop orientées vers la seule innovation
Les aides à l'industrie pharmaceutique sont aujourd'hui fortement orientées vers la recherche et développement et vers l'innovation, bien davantage que vers la production. Le soutien à l'innovation est un objectif légitime, notamment pour sécuriser la production en France des médicaments de demain, dont les biomédicaments, domaine dans lequel elle accuse un retard important. Mais, à court terme, un tel soutien n'apporte que peu de garanties du point de vue de la souveraineté sanitaire et industrielle et ne répond pas véritablement à l'enjeu de sécurisation de l'approvisionnement en médicaments matures.
Nombre des personnes entendues par la commission ont néanmoins souligné la contribution importante du CIR à l'attractivité de la France en matière de recherche. Selon le ministre délégué chargé de l'industrie Roland Lescure, « si la compétitivité de la recherche et de l'innovation françaises est aujourd'hui exceptionnelle à l'échelle mondiale, c'est grâce au CIR »663(*).
Ce constat est nuancé par l'évaluation du CIR conduite par la CNEPI en 2021. Certes, cette évaluation met en évidence un phénomène de délocalisation de la recherche des entreprises françaises, qui « suit » ainsi la production partie à l'étranger. Elle confirme que la recherche se réalise désormais de plus en plus au sein de start-ups ensuite rachetées par les grands groupes. Mais la CNEPI indique également que « le CIR n'a guère contrecarré la détérioration de l'attractivité du site France pour la localisation de la R&D des entreprises multinationales »664(*).
Surtout, si les centaines de millions d'euros de crédit d'impôt consentis chaque année par l'État via le crédit impôt-recherche ont contribué à maintenir l'activité de recherche pharmaceutique en France, ils n'ont pas empêché la fermeture des sites de production français au profit des industries chinoises ou indiennes : « Grâce au crédit d'impôt recherche, nous avons conservé la recherche, mais nous avons laissé partir les usines ; c'est incontestable. »665(*)
Mais tandis que la crise de la covid-19 a démontré que la production, en France, des médicaments essentiels était l'un des meilleurs moyens de garantir l'approvisionnement du système de santé, la contribution du CIR à cet objectif de souveraineté industrielle apparaît pour le moins contrastée.
d) Des pratiques abusives d'utilisation du CIR
Pis, le dispositif, qui bénéficie principalement aux grands groupes, à même d'optimiser la répartition de leurs activités, fait l'objet de pratiques abusives.
Entre vingt et trente-cinq contrôles fiscaux chaque année dans l'industrie pharmaceutique donnent lieu à des redressements au titre du CIR. Les montants de redressement relatifs au CIR, spécifiquement, sont inconnus, la commission n'ayant pu obtenir ces chiffres de la Direction générale des finances publiques (DGFiP). Il est étonnant que ces contrôles ne soient pas mieux documentés par l'administration chargée de les diligenter, d'autant que le secteur pharmaceutique est l'un des principaux bénéficiaires du dispositif.
La DGFiP a toutefois indiqué à la commission d'enquête avoir documenté des pratiques « optimisantes » dans le secteur. Si la plupart relèvent de la fiscalité internationale, soit en matière financière (via la déduction de charges financières), soit en matière de prix de transfert, un schéma particulier d'optimisation concerne le CIR. En particulier, selon l'administration, « a été mis en évidence un schéma d'optimisation [...] qui se présentait sous la forme suivante : une société française qui avait supporté les coûts de développement d'un candidat médicament et bénéficié de CIR à ce titre, a transféré sans contrepartie à une filiale [...] nouvellement créée, peu de temps avant que le groupe n'annonce son intention de demander des autorisations de mise sur le marché, une concession exclusive mondiale de produire et commercialiser ledit candidat médicament, en contravention avec le principe de pleine concurrence. »
En d'autres termes, cette entreprise pharmaceutique basée en France avait largement bénéficié du CIR afin de développer un médicament, avant de transférer gratuitement la propriété intellectuelle et la production du pays à l'étranger. Le crédit impôt recherche finance donc, en France, la recherche pharmaceutique indispensable à des médicaments dont la production est ensuite délocalisée. Dans le cas précité, l'administration fiscale est aujourd'hui en contentieux avec l'entreprise, estimant que celle-ci a procédé à des transferts de bénéfices à l'étranger pour un montant très significatif.
e) Un déficit de transparence sur l'utilisation et l'efficacité des aides
De plus, il existe un fort déficit de transparence sur ces aides, y compris d'un point de vue agrégé.
Concernant le CIR en particulier, la commission d'enquête déplore la difficulté à disposer de données complètes relatives aux montants consentis à l'industrie pharmaceutique, dans son ensemble comme au niveau de chaque entreprise ou groupe. Les délais importants d'obtention des données correspondantes auprès de la DGFiP ainsi que les nombreux paramètres sont révélateurs du manque de transparence et de lisibilité du dispositif.
Surtout, il n'existe pas d'information consolidée sur le montant total des aides octroyées aux établissements pharmaceutiques en France. Pourtant, les dépenses importantes consenties par les entreprises en faveur de la R&D et de l'investissement dans l'outil de production sont systématiquement citées comme justification des demandes de prix élevés dans le cadre de la négociation avec le CEPS. La qualité de la décision publique autour du soutien au secteur pharmaceutique et de la régulation du médicament dépend donc d'un bon niveau d'information sur ces aides.
Le nouvel accord-cadre entre le Leem et le CEPS comprend pourtant un article relatif aux échanges d'information, qui prévoit la déclaration, par les entreprises pharmaceutiques, du montant des investissements publics de R&D perçus. En 2021, seules sept entreprises ont déclaré avoir reçu de telles aides, principalement à la relocalisation ou dans le cadre de la pandémie de covid-19, pour un total d'environ trois millions d'euros (montant qui n'inclut évidemment pas les sommes correspondant au crédit impôt recherche).
Cette obligation nouvelle de transparence n'est pas respectée, à date, par les industriels pharmaceutiques. Interrogé par la rapporteure à ce sujet, le CEPS a précisé que « c'était la première année que nous recevions des informations sur ces investissements et, effectivement, nous n'avons pas reçu toutes les réponses attendues des entreprises conventionnées avec nous. Nous les relançons, mais nous n'avons ni la compétence ni les moyens humains d'expertiser. [...] Nous avions exprimé des réserves concernant cette absence de capacité de contrôle. Les organismes qui distribuent des aides publiques peuvent en faire état, ce qui nous apporterait une réponse. Si nous devions aller vers une expertise supplémentaire, la question des moyens se poserait effectivement, car il s'agit d'une activité vraiment différente. »666(*)
Ce constat se retrouve au niveau mondial. Selon OTMeds, les résultats de la résolution de l'Assemblée mondiale de la Santé intitulée « Améliorer la transparence des marchés de médicaments, de vaccins et d'autres produits sanitaires » et adoptée le 28 mai 2019, sont encore faibles, notamment en raison du fait que « ce texte ne tient pas compte des incitations fiscales »667(*). Selon Marc Botenga, député européen entendu par la commission d'enquête, une étude présentée au Parlement européen a démontré qu'alors que 31 milliards de dollars ont été investis par les autorités américaines et européennes et les organisations internationales dans le vaccin contre le SARS-CoV-2, les entreprises concernées ont déclaré « seulement » 16 milliards de dépenses, ce qui suggère selon lui « qu'une partie des 31 milliards a été utilisée à des fins autres que le développement et la production d'un vaccin », ce qui « pose la question fondamentale de l'utilisation des fonds publics au sein des entreprises »668(*).
f) Conditionner les aides publiques au service d'objectifs clairs de réindustrialisation et d'approvisionnement du système de santé
Face à ces constats, pour améliorer l'efficacité réelle des aides publiques, toute aide accordée doit être assortie de conditions claires visant à éviter les effets d'aubaine et les comportements abusifs. En particulier, les aides à la recherche et à la relocalisation doivent comporter des garanties relatives à la pérennité de la production sur le territoire français des médicaments ainsi soutenus.
Ces conditionnalités pourraient être de plusieurs types :
- des engagements sur le dépôt du brevet fruit de la recherche ;
- des engagements portant sur la pérennité de l'activité, en France, de l'entreprise ayant bénéficié de soutiens publics, notamment en matière de production. En d'autres termes, il s'agirait de clauses de non-délocalisation ;
- des engagements en matière d'approvisionnement du marché français en cas de tensions, comme l'a évoqué la ministre Marisol Touraine : « Ma recommandation serait que les pays développés, ceux qui investissent dans la R&D, s'appuient sur l'investissement public pour négocier des conditions d'accès et de mise à disposition » des médicaments, par exemple via des options d'achats ou des clauses relatives aux volumes de livraison ;
- des recours plus systématiques aux outils d'avance remboursable ou d'entrée au capital, qui permettent d'assurer un « retour sur investissement », ou au moins, un coût limité, à l'État. À ce titre, les modalités de soutien des projets de relocalisation de l'entreprise Seqens, avec une avance remboursable de 40 millions d'euros, une subvention de 58 millions d'euros, et surtout une entrée de Bpifrance au capital et donc dans la gouvernance de l'entreprise, doivent être saluées.
Le Gouvernement est aujourd'hui réticent à s'engager résolument dans cette voie. Concernant le CIR, le ministre de l'Industrie s'est déclaré défavorable à toute condition allant plus loin que la réalisation d'activités de recherche en France, indiquant être « extrêmement réservé quant à notre capacité à multiplier les objectifs en les concentrant sur un instrument ». S'il a affirmé que des contreparties ont été exigées dans le cadre d'autres dispositifs d'aides, comme ceux de France 2030 ou du PIIEC,669(*) il a néanmoins indiqué « qu'il est tout de même compliqué de fixer des critères objectifs pour interdire toute délocalisation ultérieure » et que « si, dans un monde ouvert, on empêche le capital de sortir de France, il ne [reviendra] pas »670(*).
Concernant les aides de Bpifrance, celles-ci seraient soumises au « respect d'un contrat moral concernant la relocalisation ». Les engagements relatifs à l'approvisionnement du marché ne sont pas non plus mobilisés par l'établissement : « Il est vrai que nulle condition ne prévoit que les médicaments devront d'abord alimenter les pharmacies françaises : on ne sait pas où va la production des usines relocalisées. Nous relocalisons pour recréer un tissu industriel français et des emplois en France, mais pas, à ce stade, dans l'objectif d'alimenter d'abord les pharmacies françaises. »
La Direction générale des entreprises réfléchit néanmoins « à demander, en contrepartie de futures aides à des actions de relocalisation et de réindustrialisation - pour l'instant, elles n'ont pas été lancées - que les industriels s'engagent à prendre des clauses garantissant la sécurité d'approvisionnement. Elles permettraient à l'État de demander à un industriel de fournir en priorité le marché français ou d'accélérer sa livraison, en cas de pénuries. »671(*)
Un déploiement plus large ou plus systématique de ce type de conditionnalité des aides publiques devra évidemment s'opérer en cohérence avec le droit européen. Le Critical Medicines Act demandé par une vingtaine de pays européens pourrait permettre de clarifier ou de modifier les règles relatives aux aides d'État ou à la concurrence, afin de faciliter l'utilisation de telles clauses, comme l'a souligné le ministre de l'Industrie lors de son audition.
Recommandation n° 30 : Conditionner les aides publiques et incitations fiscales à l'industrie pharmaceutique, améliorer la transparence quant à leur utilisation et leur évaluation qualitative, et les cibler sur les projets à plus forte valeur ajoutée du point de vue de la souveraineté sanitaire et industrielle.
* 644 Audition de M. Michel Rao, sous-directeur des industries de santé, des biens de consommation et de l'agroalimentaire à la Direction générale des entreprises, le 4 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc11
* 645 Audition de M. Michel Rao, sous-directeur des industries de santé, des biens de consommation et de l'agroalimentaire à la Direction générale des entreprises, le 4 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc11
* 646 Réponses de la DGE au questionnaire de la commission d'enquête.
* 647 Audition de Mme Lise Alter, directrice générale de l'agence de l'innovation en santé, le 16 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc6
* 648 Audition de M. Michel Rao, sous-directeur des industries de santé, des biens de consommation et de l'agroalimentaire à la Direction générale des entreprises, le 4 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc11
* 649 Réponses à la commission d'enquête
* 650 Audition de représentants du Syndicat de l'industrie chimique organique de synthèse et de la biochimie (Sicos biochimie), le 30 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230529/ce_penurie.html#toc2
* 651 Cette liste est consultable à l'adresse suivante : https://sante.gouv.fr/IMG/pdf/liste-medicaments-essentiels_acc.pdf
* 652 Le guichet sera établi dans le cadre d'un nouveau volet de l'AAP « Capacités et industrialisation 2030 » financé par France 2030, qui ciblera particulièrement la chaîne de valeur des médicaments essentiels les plus vulnérables aux importations extra-européennes, selon la DGE. Les médicaments visés seraient les 48 premiers médicaments d'intérêt stratégique sur le plan industriel et sanitaire (MSIS).
* 653 Ce dossier est consultable à l'adresse suivante : https://sante.gouv.fr/IMG/pdf/dossier_de_presse_-_relocalisations_de_medicaments_essentiels.pdf
* 654 Audition de M. Nicolas Dufourcq, directeur général de Bpifrance, le 16 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc4
* 655 La dimension européenne de la relocalisation sera détaillée dans le IV de la présente troisième partie du rapport.
*
656 Pour consulter la publication :
https://publication.enseignementsup-recherche.gouv.fr/eesr/FR/T268/le_credit_d_impot_recherche_dispositif_de_soutien_a_la_r_d_des_entreprises/
* 657 Champ retenu : impôt sur les sociétés, taxe foncière sur la propriété bâtie, cotisation sur la valeur ajoutée des entreprises, cotisation foncière des entreprises.
* 658 https://www.strategie.gouv.fr/sites/strategie.gouv.fr/files/atoms/files/fs-2021-rapport-cnepi-cir-juin.pdf
* 659 Transformer l'essai de l'innovation : un impératif pour réindustrialiser la France, rapport d'information n° 655 (2021-2022) de Mme Vanina Paoli-Gagin, fait au nom de la MI Excellence de la recherche/innovation, déposé le 8 juin 2022.
*
660 Le rapport est consultable à l'adresse
suivante :
https://www.strategie.gouv.fr/sites/strategie.gouv.fr/files/atoms/files/fs-2020-rapport-politique_industrielle-chapitre-8.pdf
* 661 Audition de Mme Pauline Londeix et M. Jérôme Martin, co-fondateurs de l'Observatoire de la transparence dans les politiques du médicament (OTMeds), le 5 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230403/ce_penurie.html#toc4
* 662 Par souci de clarté, la notion « d'aides publiques » utilisée dans cette partie inclut tant les incitations fiscales, dont crédits d'impôt, que les aides directes (par exemple les aides à l'investissement) ; et ce, bien que selon Philippe Lamoureux, directeur général Leem entendu par la commission d'enquête, « le CIR n'est pas une aide ; c'est une incitation fiscale ».
* 663 Audition de M. Roland Lescure, ministre délégué chargé de l'industrie, le 25 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230522/ce_penurie.html#toc4
* 664 https://www.strategie.gouv.fr/sites/strategie.gouv.fr/files/atoms/files/fs-2021-rapport-cnepi-cir-juin.pdf
* 665 Audition de M. Nicolas Dufourcq, directeur général de Bpifrance, le 15 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230515/ce_penurie.html#toc4
* 666 Audition de MM. Philippe Bouyoux, président, et Jean-Patrick Sales, vice-président pour le médicament, du Comité économique des produits de santé, le 28 février 2023 : https://www.senat.fr/compte-rendu-commissions/20230227/ce_penurie.html#toc2
* 667 Audition de Mme Pauline Londeix et M. Jérôme Martin, co-fondateurs de l'Observatoire de la transparence dans les politiques du médicament (OTMeds), le 5 avril 2023 : https://www.senat.fr/compte-rendu-commissions/20230403/ce_penurie.html#toc4
* 668 Audition de M. Marc Botenga, député européen, le 3 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc9
* 669 L'AMI « Capacity building » avait ainsi prévu des clauses d'option d'achat pour les aides de Bpifrance et des clauses de non-délocalisation, portant uniquement sur la durée d'exécution du contrat,, selon le ministre Roland Lescure. Dans le cadre du PIIEC enfin, il a indiqué que la France a « écarté un ambitieux projet de recherche et de développement » car « les garanties d'industrialisation sur le sol français n'étaient pas suffisantes, étant donné l'ampleur des subventions prévues ».
* 670 Audition de M. Roland Lescure, ministre délégué chargé de l'industrie, le 25 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230522/ce_penurie.html#toc4
* 671 Audition de M. Michel Rao, sous-directeur des industries de santé, des biens de consommation et de l'agroalimentaire à la Direction générale des entreprises, le 4 mai 2023 : https://www.senat.fr/compte-rendu-commissions/20230501/ce_penurie.html#toc11