III. LA RECHERCHE DE PROTÉINES ALTERNATIVES
A. ÉTAT DES LIEUX DES PROTÉINES ALTERNATIVES
La réflexion sur l'introduction de protéines alternatives à celles prédominantes aujourd'hui en alimentation humaine s'est intensifiée depuis quelques années. Les préoccupations quantitatives (nourrir plus d'habitants), de santé (trouver des alternatives aux régimes trop carnés) ou encore environnementales (réduire les émissions de GES) se rejoignent.
Parmi les travaux récents sur cette question, on peut citer notamment :
- un rapport du Conseil général de l'alimentation, de l'agriculture et des espaces ruraux (CGAAER) sur la diversification de la ressource protéique en alimentation humaine et animale d'avril 201981(*) ;
- un rapport de l'Académie des technologies sur l'avenir des protéines alternatives82(*) de juillet 2023 ;
- une étude de l'Unité de prospective scientifique (STOA) du service de recherche du Parlement européen (EPRS) sur les sources alternatives de protéines pour la nourriture et les aliments pour animaux, d'avril 202483(*).
Les modes alternatifs de production de protéines pour l'alimentation se situent à des degrés de maturité différents. Certaines technologies sont connues depuis longtemps, d'autres émergent. Les perspectives d'adoption de nouvelles sources de protéines dans l'alimentation dépendent de très nombreux facteurs :
- la sécurité sanitaire évidemment, qui passe par le respect de normes et procédures de mise sur le marché ;
- la capacité à répondre à l'impératif d'une nourriture produite à un coût abordable ;
- enfin la levée de certaines barrières psychologiques ou pratiques qui empêchent les consommateurs de transformer leurs habitudes.
Les alternatives végétales aux protéines animales ayant déjà été évoquées, cette partie sera consacrée aux alternatives non basées sur des plantes terrestres : la fermentation de précision, les cultures cellulaires (parfois appelée viande in vitro), les insectes et l'algoculture.
Quels sont les avantages et inconvénients pour la santé et l'environnement de ces protéines alternatives ? Les perspectives qu'elles offrent sont-elles réalistes ? Peuvent-elles constituer une alternative aux sources actuelles de protéines dans l'alimentation humaine et animale ou n'ont-elles pour vocation que d'être des sources d'appoint ou complémentaires ?
1. La fermentation de précision
a) Définition et procédés
La fermentation est un processus ancien et bien connu, qui permet de produire des aliments (yaourts, tofu, tempeh...) ou encore des boissons (bière). Elle se produit grâce à l'action de micro-organismes (bactéries, levures, champignons filamenteux) qui, par la sécrétion d'enzymes, transforment la matière organique avec laquelle ils sont en contact, dans des conditions dites anaérobies (c'est-à-dire dans un milieu ne recevant pas d'apports d'oxygène extérieur, par exemple dans une cuve fermée).
À côté de la fermentation traditionnelle, les progrès de la biologie de synthèse permettent désormais de développer des techniques de fermentation de précision. Il s'agit d'utiliser les différentes catégories de micro-organismes précités pour produire en environnement contrôlé des protéines identiques à celles issues d'animaux, voire d'autres constituants cellulaires.
La fermentation de précision comprend trois étapes essentielles :
- la première phase (dite de sélection) consiste en une réécriture du génome de micro-organismes pour leur conférer la capacité de synthétiser une nouvelle protéine (par exemple la caséine ou la lactalbumine du lait, ou encore l'ovalbumine des oeufs) ;
- la deuxième phase (dite de culture) consiste à faire croître et se multiplier les micro-organismes dans des bioréacteurs ;
- la troisième phase (de purification) consiste en l'isolement puis l'extraction et la purification des protéines, pour retirer le substrat et ne conserver que les protéines cibles.
La croissance et la multiplication des micro-organismes s'effectuent dans un fermenteur grâce à un substrat alimentaire, qui doit être riche en sucres, pour apporter le carbone et l'énergie aux réactions métaboliques nécessaires à la synthèse des protéines. Ce substrat peut provenir de cultures spécifiques mais aussi utiliser des coproduits agricoles et des résidus agro-alimentaires. Ce substrat doit aussi contenir de l'azote qui doit être apporté de l'extérieur.
Les micro-organismes présents dans le fermenteur interagissent avec le substrat alimentaire. Des gènes d'autres organismes ont été introduits dans l'ADN de ces micro-organismes pour leur permettre de synthétiser les molécules souhaitées, en l'occurrence des protéines. Mais la fermentation de précision permet de créer de nombreuses catégories de molécules, comme des molécules organoleptiques destinées à donner un arôme à un produit alimentaire.
Plusieurs méthodes existent pour réaliser une fermentation de précision. La plus utilisée est celle du batch dans lequel on introduit le substrat et les micro-organismes au début puis, après épuisement du substrat, le produit est récupéré. Toutefois, il existe aussi des procédés dits de chemostats où le substrat et le produit circulent de telle sorte qu'ils conservent la même composition chimique tout au long du procédé. Il est ainsi possible de produire en continu. Il existe également des procédés hybrides où un flux de substrat est apporté au bioréacteur mais le produit n'est récupéré qu'à la fin.
Dans tous les cas, les paramètres du bioréacteur doivent être contrôlés pour que la fermentation soit un succès. Il s'agit par exemple de la température, du pH ou du taux d'oxygénation (qui est régulé avec un apport de dioxygène gazeux). Un autre paramètre à prendre en compte est la stoechiométrie84(*) du substrat et des micro-organismes afin de maximiser le rendement mais aussi de contrôler la fermentation avec la présence d'un nutriment limitant. Le choix de la valeur de ces paramètres dépend largement de la souche microbienne utilisée et des produits visés.
Le produit récupéré en sortie des fermenteurs doit ensuite être purifié. Il faut séparer les molécules valorisables des résidus par des procédés de filtration et de purification (charbon actif, filtration membranaire, chromatographie, précipitation...).
b) Quels débouchés dans le domaine des protéines alimentaires ?
La fermentation de précision permet de produire potentiellement toutes les protéines. Elle peut donc être utilisée dans beaucoup de domaines.
Elle est déployée depuis les années 1980 dans l'industrie pharmaceutique pour la production d'insuline, ce qui a permis de s'affranchir de la nécessité d'en chercher dans la nature. Pour que l'industrie pharmaceutique produise un kilogramme d'insuline destiné à traiter des patients diabétiques, il était nécessaire de récupérer le pancréas de pas moins de 50 000 porcs ou vaches, ce qui posait d'importants problèmes d'approvisionnement et de traitement, ainsi que des problèmes d'allergie et de pureté. En 1982, en injectant une séquence d'ADN d'insuline humaine dans une bactérie E.Coli, celle-ci a été capable de produire des molécules d'insuline humaine de synthèse, surmontant ainsi les limitations liées à l'utilisation d'animaux. En 2000, 99 % de l'insuline était produite par ce procédé biotechnologique85(*).
Mais la fermentation de précision peut aussi viser la fabrication d'aliments riches en protéines.
Elle est ainsi utilisée depuis longtemps dans l'industrie fromagère pour produire de la chymosine, en remplacement de la présure prélevée dans l'estomac des veaux, pour faire cailler le fromage.
Les progrès des technologies génétiques, notamment le développement de l'outil CRISPR-Cas9 (ciseau moléculaire), permettent aujourd'hui d'éditer le génome des levures et de leur faire produire des molécules d'intérêt pour la supplémentation alimentaire, par exemple la production de vitamine B12 non animale pour les régimes végétariens et végétaliens86(*).
Aujourd'hui, la fermentation de précision est une voie suivie pour la production de protéines destinées à l'alimentation humaine. Plusieurs start-up se sont lancées en France dans des projets ambitieux :
- Standing Ovation produit des caséines destinées aux fabricants de fromage, de glace, de crème et même de barres chocolatées. L'objectif est de fournir un ingrédient alternatif à une caséine d'origine animale à l'industrie agroalimentaire ;
- Verley (anciennement Bon vivant) propose une alternative au lactosérum d'origine animale, en visant à remplacer cette protéine laitière conventionnelle par des protéines présentant des caractéristiques intéressantes pour l'industrie agroalimentaire, par exemple ayant une plus grande stabilité thermique ;
- Nutropy vise la fabrication de fromages sans lait de vache, à partir de protéines fabriquées dans des bioréacteurs.
Dans le monde, de nombreuses start-up se lancent dans la même course, en particulier dans le domaine des alternatives au lait, aux États-Unis (Perfect Day, New Culture), en Israël (Remilk, Imagindairy), en Allemagne (Formo), aux Pays-Bas (Those Vegan Cowboys) ou encore en Australie (Change Foods).
La fermentation de précision s'étend à d'autres domaines, comme la recherche d'alternatives aux protéines issues des oeufs (Clara Foods, devenue The Every Company) : la production d'ovalbumine par fermentation de précision vise ainsi à fournir l'industrie agroalimentaire d'alternatives pour fabriquer des pâtisseries ou des sauces.
La production de gélatine est aussi possible par la fermentation de précision (Geltor).
c) Avantages de la fermentation de précision dans l'alimentation
• La fermentation de précision présente des avantages environnementaux.
Elle permet une réduction drastique des émissions de gaz à effet de serre (GES) par rapport à des protéines animales produites naturellement, en particulier celles issues du lait, du fait de l'importance des rejets de méthane liés à la fermentation entérique des ruminants.
Cette réduction est en partie contrebalancée par des émissions supplémentaires résultant des besoins en énergie des installations de fermentation de précision, qui pourraient être du même ordre de grandeur que ceux nécessaires pour des productions conventionnelles. Mais les émissions dépendent du choix de la source d'énergie, qui peut être décarbonée.
Les études montrent un potentiel de réduction des émissions de GES de 80 à 99 %. Une étude ACV réalisée pour Bon Vivant montre que les émissions de GES sont plus faibles de 72 % par rapport à la production naturelle de protéines de lait.
La fermentation de précision permet aussi une utilisation minimale des terres par rapport à une production animale : elle se déroule dans des installations compactes, réduisant considérablement l'empreinte foncière nécessaire pour produire une quantité équivalente de protéines. La même étude ACV précitée estimait l'économie d'utilisation des terres à 99 %.
La fermentation de précision consomme également moins d'eau que des productions de protéines issues de l'élevage d'animaux. Là encore, l'étude ACV précitée avançait une baisse de 81 %.
• La fermentation de précision présente aussi un intérêt au regard d'enjeux éthiques liés au bien-être animal : elle permet de produire des protéines animales (comme la caséine du lait ou l'ovalbumine de l'oeuf) sans nécessiter l'élevage, l'abattage ou l'exploitation des animaux.
• La fermentation de précision offre la possibilité de produire des protéines très spécifiques, avec certaines propriétés fonctionnelles (solubilité, texture, capacité moussante, gélifiante) ou nutritionnelles (profil d'acides aminés équilibré, enrichissement en certains nutriments), et en obtenant une grande homogénéité du produit fini, qui serait difficile à atteindre par un procédé traditionnel.
La fermentation de précision permet par ailleurs d'éliminer des substances allergènes ou encore de créer des aliments enrichis.
Elle permet de massifier la production de protéines qui seraient rares au sein des sources classiques ou encore de s'affranchir des incertitudes liées à des soucis d'approvisionnement liés à des évènements climatiques (sécheresse), ou des maladies animales, et de s'affranchir du cycle des saisons qui contraint les productions végétales.
• Enfin, la fermentation de précision constitue un processus rapide de production de protéines : les levures ou bactéries utilisées ont des cycles de vie courts et se reproduisent en quelques heures ou quelques jours au sein des bioréacteurs. Le processus de production suit une courbe exponentielle et le facteur limitant de la production est la taille des fermenteurs.
• La réussite de la fermentation de précision suppose toutefois de maîtriser certains risques, au premier rang les risques sanitaires. Un rapport de la FAO publié début 202587(*) insiste sur la nécessité de définir un cadre réglementaire strict pour garantir la sécurité sanitaire du processus industriel de production, notamment concernant le choix des micro-organismes, l'élimination des résidus chimiques et coproduits, les risques de contamination microbienne ou encore l'existence d'allergènes ou toxines accompagnant les protéines produites.
d) Quelles perspectives pour la fermentation de précision dans l'alimentation ?
La fermentation de précision a le potentiel de permettre une production massive de protéines alimentaires, et c'est d'ailleurs l'un des objectifs de son développement.
Mais la production à grande échelle suppose de mettre en service des bioréacteurs de grande capacité capables de contenir des dizaines, voire des centaines de milliers de litres, permettant de cultiver de grandes quantités de micro-organismes.
L'adoption des techniques de fermentation de précision suppose aussi d'atteindre des coûts de production compétitifs. Actuellement, le coût de production des protéines par fermentation de précision peut être plus élevé que celui des protéines animales traditionnelles ou de certaines protéines végétales produites à très grande échelle. La réduction de ces coûts est un enjeu majeur pour atteindre une production massive compétitive.
En France, aujourd'hui, la fermentation reste cantonnée à des petites installations et à des preuves de concept. Le passage à l'échelle industrielle (scale-up) nécessite des investissements importants. Par ailleurs, la mise sur le marché pour l'alimentation humaine des protéines alternatives obtenues par fermentation de précision nécessite de passer par un long processus réglementaire sur chacun des marchés concernés.
Néanmoins, le potentiel de développement de cette technologie paraît important88(*), car elle n'offre pas seulement une possibilité de substitution à des ingrédients existant de manière traditionnelle, mais elle élargit la gamme des produits pouvant être utilisés pour fabriquer des aliments, en modifiant les apports nutritionnels, mais aussi le goût ou la texture, et en offrant aux industriels un potentiel d'innovation culinaire.
2. Les aliments cellulaires ou « viande in vitro »
a) Définition et procédés
L'idée de cultiver en laboratoire des tissus vivants existe depuis au moins un siècle, avec des applications envisagées prioritairement en médecine régénérative. Mais les premières applications alimentaires n'ont qu'une vingtaine d'années et le premier « steak » cultivé en laboratoire a été présenté au public en 2013 aux Pays-Bas.
Une note d'analyse du centre d'études et de prospective du ministère de l'agriculture et de l'alimentation de mai 2021 insistait sur la nécessité de s'intéresser à ce sujet89(*).
Le Sénat a examiné cette nouvelle technologie dans un rapport d'information très complet publié en avril 202390(*), appelant à une grande vigilance sanitaire et dans l'information du consommateur, mais insistant aussi sur la nécessité de poursuivre les recherches scientifiques et technologiques.
La fabrication d'aliments cellulaires est plus complexe que la fermentation de précision. Il existe de multiples manières de procéder, mais quatre étapes sont essentielles :
- la première étape est celle de la sélection et du prélèvement des cellules sources animales, soit grâce à une biopsie sur un animal vivant, soit en allant chercher des cellules embryonnaires ou des cellules en catalogue dans une banque de cellules. Les cellules souches sélectionnées doivent avoir la possibilité de se différencier en cellules musculaires, l'objectif étant d'obtenir in fine un tissu musculaire similaire à celui de la viande ;
- la deuxième étape est celle de la prolifération cellulaire réalisée dans un environnement de culture contrôlé, en environnement stérile et à une température optimale de 37 °C avec 5 % de CO2 pour maintenir un pH similaire à celui du sang de mammifère, en immergeant les cellules dans un milieu de culture, au sein d'un bioréacteur. Le milieu de culture fournit les nutriments nécessaires à la croissance et la division des cellules (sucres, acides aminés, vitamines, minéraux, facteurs de croissance).
Historiquement, le milieu de culture requis était du sérum de veau foetal (SVF ou FBS en anglais). Ce liquide est issu du sang des foetus extraits des carcasses de vaches gestantes abattues. Il est extrêmement riche avec entre 200 et 400 protéines différentes ainsi que des milliers de molécules (dont des facteurs de croissance) dans des concentrations diverses. Cette diversité lui donne une grande versatilité et permet de cultiver une grande variété de cellules.
Toutefois, la disponibilité de SVF nécessite l'abattage de vaches gestantes et n'est donc pas économiquement et éthiquement viable. C'est pourquoi la culture cellulaire s'effectue aujourd'hui grâce à des milieux de culture synthétiques alternatifs au SVF. Il est en effet possible de produire un milieu de culture cellulaire plus pauvre mais spécifique au type de cellule visée ;
- la troisième étape est celle de la différenciation cellulaire. Le milieu de culture est modifié pour que les cellules souches puissent se différencier en trois composants principaux de la viande : le muscle, la graisse et le tissu conjonctif. Les cellules musculaires commencent à s'aligner et à fusionner pour former des structures allongées appelées myotubes, qui s'organisent ensuite en fibres musculaires.
Cette étape peut être suivie d'une phase de structuration permettant de texturer la viande de culture, en empilant les fibres musculaires ;
- enfin, la quatrième et dernière étape consiste à récolter le produit en sortie de bioréacteur, le nettoyer (en retirant les résidus du milieu de culture) et éventuellement l'assembler avec d'autres ingrédients (graisses, arômes, colorants).
b) Quels débouchés ?
La technologie de la culture de cellules peut potentiellement concerner une grande variété d'applications dans le domaine de l'alimentation : on peut vouloir fabriquer des équivalents à la viande de boeuf, mais aussi de porc, de poulet ou encore des équivalents de la chair du poisson.
Contrairement à la fermentation de précision, l'objectif n'est pas de produire uniquement une protéine, mais un aliment plus complexe qui ressemble dans sa composition à un produit issu de l'abattage d'un animal.
Pour autant, on peut douter qu'il s'agisse d'un substitut à la viande. Le rapport du CGAAER de 2019 souligne que la recherche d'équivalence entre viande naturelle et viande de synthèse peut rencontrer une importante limite dans la mesure où « la maturation de la viande qui s'opère naturellement après l'abattage grâce à la présence d'acide lactique issu de la dégradation du glycogène, permettant in fine d'attendrir la fibre musculaire » n'existe pas pour la viande de synthèse.
La culture cellulaire pourrait en revanche permettre d'innover par rapport aux produits traditionnels existants : elle ouvre la voie à la possibilité de mettre sur le marché des produits carnés avec des profils nutritionnels spécifiques (par exemple, contenant moins de graisses saturées, enrichis en certains nutriments) ou des textures innovantes.
La culture cellulaire pourrait permettre par ailleurs de fournir au consommateur des produits alimentaires dont les processus de production traditionnels sont menacés d'interdiction, en particulier au nom du bien-être animal.
Ainsi, le foie gras, réalisé grâce à une technique de gavage, est interdit à la commercialisation par la loi californienne qui considère le gavage comme un acte de cruauté envers les animaux. Dans ce contexte, la start-up française Gourmey cultive des cellules de canard pour fabriquer un aliment proche du foie gras de canard sur les plans nutritionnel, structurel et gustatif.
La culture cellulaire se positionne davantage comme un complément que comme une alternative à la viande traditionnelle. Mais on ne peut exclure que son développement réduise à due concurrence les volumes de production de l'élevage traditionnel. C'est d'ailleurs là que réside l'un des arguments majeurs portés par les promoteurs de la viande de culture.
c) Quels avantages des cultures cellulaires ?
Les défenseurs de la culture cellulaire mettent en avant de nombreux arguments.
• Le premier avantage serait lié à des considérations éthiques et de bien-être animal. La culture cellulaire évite d'abattre des animaux pour produire de la viande. Par ailleurs, les techniques de prélèvement de cellules sont peu invasives et donc posent peu de problèmes éthiques.
• Le second avantage serait environnemental : la viande in vitro réduisant le nombre d'animaux de ferme élevés, elle conduit à la fois à abaisser les rejets directs de méthane (pour les ruminants) et la consommation de terres destinées à produire l'alimentation animale.
Il est cependant difficile d'établir une évaluation fiable de l'impact environnemental que pourrait avoir ce procédé s'il était industrialisé91(*). Le rapport du Sénat estime que « sous certaines conditions, les aliments cellulaires permettraient un allègement de l'empreinte environnementale de l'alimentation ». Mais ces conditions sont loin d'être toutes remplies.
En effet, pour la fabrication des milieux de culture et pour le chauffage des incubateurs, la viande de culture consommerait davantage d'énergie que la production de viande de porc ou de poulet et peut-être même plus que pour la viande de boeuf.
Tout dépend alors des sources d'énergie utilisées pour la culture cellulaire.
Deux études (certes un peu anciennes, datant de 2011 et 2015) mettent en évidence des besoins en énergie plus importants pour la viande artificielle.
Comparaison de la consommation d'énergie de la viande in vitro, de la viande de volaille, de porc et de boeuf (modèle feed-lot) dans l'étude de 2015 et celle de 2011
Source : Hocquette, 2021
• Il pourrait aussi y avoir des avantages sanitaires à développer la culture cellulaire. En effet, produite dans un environnement contrôlé et stérile, la viande de culture pourrait présenter moins de risques de contamination par des bactéries pathogènes comme la salmonelle ou l'Escherichia coli. Par ailleurs, elle contribuerait moins à la diffusion de résidus médicamenteux dans l'environnement, une partie de ceux-ci résultant des traitements des troupeaux. Cela n'exclut pas de rester vigilant sur les risques sanitaires, car les productions industrielles peuvent aussi connaître des échecs sur ce plan et générer des pollutions dans leur environnement immédiat.
• Enfin, la culture cellulaire peut permettre une production plus rapide, mais le rythme de multiplication des cellules n'est pas comparable à celui de la fermentation de précision. Le développement des cellules prend davantage de temps. Selon l'association Agriculture Cellulaire France92(*), qui fédère les acteurs de ce nouveau secteur, il faut environ cinq à sept semaines pour produire de la « viande cultivée ». C'est une durée comparable à celle de l'élevage d'un poulet. Les avantages en termes de durée de production pourraient davantage concerner des cultures cellulaires alternatives à des produits animaux à longue durée de croissance, comme le boeuf.
d) Quelles perspectives pour les aliments cellulaires ?
La technologie est encore loin d'être totalement mature. Le développement de la « viande de culture » est encore largement une démarche expérimentale, un pari, porté par des start-up.
Le rapport du Sénat identifie 110 entreprises dans le monde travaillant à produire des aliments cellulaires.
Il note que le développement de ces alternatives à la viande se heurte à quelques obstacles importants.
• Le premier obstacle réside dans les qualités du produit fini : les fabricants ont encore du mal à reproduire la texture complexe et le goût de la viande traditionnelle, qui est composée de différents types de tissus (muscle, graisse, tissu conjonctif). Les premières applications pourraient donc se cantonner à la fabrication d'ingrédients de substitution à des préparations industrielles carnées. Le rapport du Sénat indique ainsi que « les rares entreprises qui souhaitent imiter des pièces de viande entières - en particulier Mosa Meat et Aleph Farms - admettent qu'il leur faudra encore de nombreuses années avant d'envisager la production à grande échelle d'une entrecôte, d'une cuisse de poulet ou d'une côte de porc ».
• Le second obstacle est celui du coût de production. La viande artificielle est encore loin d'être compétitive par rapport à la viande issue d'animaux d'élevage. Une partie importante des charges d'exploitation correspond à la phase de croissance des cellules dans les milieux de culture. Une manière de réduire les coûts serait que les cellules musculaires bovines produisent leurs propres facteurs de croissance, plutôt que d'avoir à les prévoir initialement dans le milieu de culture. Dès lors qu'il n'y a pas encore d'industrialisation de la production à grande échelle, il est difficile d'anticiper ce que seront les coûts de production demain.
• Un autre obstacle relève des préférences du consommateur : celui-ci serait-il prêt à faire des aliments cellulaires une des composantes de ses repas ? Comme le remarque le rapport du Sénat, « les aliments cellulaires ne pourront répondre, par définition, aux attentes de naturalité ». Une étude menée en 2020 par AgroSud Dijon, l'université de Bath au Royaume-Uni et l'Ifop montrait que 44 % des Français étaient prêts à goûter de la viande « in vitro » et 34 % des consommateurs de viande étaient même prêts à remplacer la viande « classique » par sa version alternative cellulaire. Les Allemands étaient encore plus favorables avec des taux de réponses aux mêmes questions de respectivement 58 % et 53 %. Globalement, l'incertitude prédomine sur l'adoption, par le consommateur, de produits issus de la culture cellulaire.
• Enfin, l'accès au marché des aliments issus de culture cellulaire passe aussi par un processus réglementaire, qui est exigeant et peut être long. En Europe, ce sont les règles dites « Novel Food » qui s'appliquent et supposent une évaluation des risques par l'Autorité européenne de sécurité des aliments (EFSA).
Malgré les obstacles, plusieurs acteurs poursuivent leur plan de développement des aliments cellulaires. Ainsi, la société Vital Meat, qui a pour actionnaire principal le groupe spécialiste de génétique animale Grimaud a mis au point une technologie de production de cellules souches issues de poulet, pour fabriquer des nuggets.
Les aliments cellulaires connaissent un début de commercialisation. À Singapour, de la viande cellulaire de poulet est autorisée à la vente aux consommateurs depuis 2020. Aux États-Unis, les sociétés Upside Foods et Good Meat ont aussi obtenu de l'USDA en 2023 une autorisation de mise sur le marché de viande de poulet cultivée en laboratoire. Au Royaume-Uni, la start-up Meatly a obtenu en 2024 de la part des autorités sanitaires britanniques l'autorisation de commercialiser sa viande de poulet cultivée en laboratoire à destination des animaux de compagnie.
3. Les insectes
a) Une source intéressante de protéines
(1) L'insecte, un aliment de qualité
Les insectes sont consommés en alimentation humaine depuis des siècles dans plusieurs régions du monde, en particulier en Asie, en Afrique ou en Amérique latine.
En 2013, la FAO a publié un rapport intitulé « insectes comestibles, perspectives pour la sécurité alimentaire et l'alimentation animale »93(*) qui envisage le développement de la consommation d'insectes comme une voie intéressante de diversification des apports en protéines, tant en alimentation humaine qu'animale.
Certains insectes ont en effet une valeur nutritionnelle élevée. S'appuyant sur une étude scientifique compilant la valeur nutritionnelle de 236 insectes comestibles, le rapport de la FAO estime que « de nombreux insectes comestibles fournissent des quantités satisfaisantes d'énergie et de protéines, satisfont les besoins humains en acides aminés, sont riches en acides gras mono et polyinsaturés, et sont riches en micronutriments tels que le cuivre, le fer, le magnésium, le manganèse, le phosphore, le sélénium et le zinc, ainsi qu'en vitamines comme la riboflavine (B2), l'acide pantothénique (B5), la biotine (B8) et, dans certains cas, l'acide folique (B9) ».
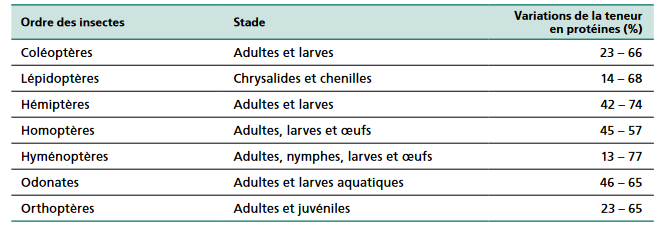
Les teneurs en protéines des insectes peuvent ainsi être particulièrement élevées, plus même que pour la viande. En outre, les protéines d'insectes sont généralement considérées comme étant « de bonne qualité » car elles ne présentent aucune carence en acides aminés limitants.
Teneurs en protéines brutes des insectes
Source : Xiaoming et al., 2010
Cependant, la consommation d'insectes comporte certains risques sanitaires qu'il convient de maîtriser, comme l'a rappelé l'Anses dans un avis de 201594(*) :
- certains insectes comportent des substances toxiques qu'ils ont fabriquées eux-mêmes pour se défendre ou qu'ils ont accumulées dans leur environnement ou par leur alimentation, par exemple des venins. Il convient de retirer ces substances toxiques ou de ne consommer que des larves d'insectes, qui n'ont pas encore eu le temps de sécréter ces substances toxiques ;
- des substances antinutritionnelles sont également présentes chez certaines espèces d'insectes : acide phytique, acide cyanhydrique, oxalates, tannins. L'avis de l'Anses note également que la chitine, qui est un constituant de l'exosquelette des insectes et l'un de ses dérivés, le chitosan, sont difficilement digestibles ;
- surtout, la consommation d'insectes expose à des risques élevés d'allergies. Il existe en effet des allergènes communs à l'ensemble des arthropodes, c'est-à-dire aux mollusques, crustacés, acariens et insectes ;
- enfin, comme pour toute production industrielle, il existe des risques microbiologiques qu'il convient de maîtriser en veillant à de bonnes conditions sanitaires d'élevage.
L'ensemble de ces risques sanitaires est encore mal connu. La mise sur le marché de produits alimentaires à base d'insectes pour l'alimentation humaine doit donc être envisagée avec prudence.
L'avis de l'Anses précise que « compte tenu du métabolisme très particulier des insectes, l'élevage, la préparation et la commercialisation d'insectes pour l'alimentation devraient être entourés de précautions spécifiques, et en particulier faire l'objet de recherches analytiques des éventuelles substances toxiques dans les produits finis, au cas par cas », ce que prévoit au demeurant la réglementation européenne.
(2) Des avantages environnementaux indéniables
Un des atouts de la production d'insectes est leur faible impact sur l'environnement.
La FAO estime que les élevages d'insectes émettent moins de GES que la plupart des autres sources de protéines animales et nécessitent moins d'eau. La littérature scientifique récente ne donne cependant pas un avantage décisif aux insectes sur ce point. Ainsi, une étude de 202195(*) estime que la production de protéine d'insecte n'est pas forcément moins émettrice que la production de protéine de poulet de chair. La vitesse de croissance des insectes est en effet dépendante de la chaleur, ce qui nécessite des consommations énergétiques si les élevages d'insectes ne disposent pas naturellement d'un environnement chaud.
Un autre avantage environnemental de la production d'insectes réside dans son moindre besoin en eau que les productions animales et végétales, même s'il est difficile de disposer de chiffres indiscutables.
Toujours selon la FAO, les superficies requises pour élever des insectes sont nettement moins importantes que celles nécessaires à la production animale. Selon la société Mutatec96(*), il suffit d'1,5 hectare pour produire l'équivalent en protéines de 800 hectares de soja.
Les insectes présentent un très bon rendement de conversion des intrants alimentaires en protéines. Les grillons, par exemple, ont besoin de 12 fois moins d'intrants alimentaires que les bovins pour produire la même quantité de protéines. Le rapport du CGAAER précité met en avant pour les insectes un taux de conversion protéique aussi bas que celui des poissons d'élevage (proche de 1), trois à cinq fois meilleur que celui des mammifères. Concrètement, ils ont besoin de peu d'aliments pour croître, avec une vitesse de croissance qui dépend de l'espèce choisie et du degré de maturité cible (les récoltes de larves peuvent se faire après quelques semaines).
Les élevages d'insectes sont nourris avec des sous-produits non consommables par l'homme (par exemple le son du blé), et peuvent venir utiliser la chaleur résiduelle d'installations industrielles. Ils peuvent donc facilement s'intégrer dans des systèmes d'économie circulaire.
La production de déchets est également beaucoup plus réduite par unité d'aliment ingéré du fait du caractère poïkilotherme des insectes (leur température corporelle s'ajuste à celle du milieu) et les excréments des insectes, que l'on nomme « frass », peuvent ensuite être utilisés comme fertilisants.
Enfin, l'exploitation d'élevages d'insectes est industrialisable à toutes les phases : ponte d'oeufs et éclosion, croissance, abattage et transformation.
L'abattage est simple, par congélation à - 18 °C pendant 24 heures ou par ébouillantage, qui assure la pasteurisation du produit mais peut dégrader certains nutriments. La transformation pour les conserver prend ensuite la forme d'une déshydratation, d'une friture, d'un toastage, d'une lyophilisation ou encore d'une fermentation lactique.
b) Une alternative qui peine à décoller
(1) Un développement orienté vers l'alimentation animale
Malgré ses atouts, la production d'insectes reste limitée en France et en Europe.
L'étude du Parlement européen précitée rappelle que seulement quatre espèces d'insectes ont été autorisées en Europe pour l'alimentation humaine : le grillon domestique (Acheta domesticus) ; le petit ténébrion meunier (Alphitobius diaperinus) ; le criquet migrateur (Locusta migratoria) ; et le ténébrion meunier jaune (Tenebrio molitor). Sept espèces ont été autorisées en alimentation animale. Ce sont essentiellement le ténébrion meunier jaune et la mouche soldat noire (Hermetia illucens) qui sont utilisés sous forme de protéines animales transformées (PAT), c'est-à-dire de farines, pour nourrir les poissons d'élevage, les porcs ou les volailles.
Les quantités produites en Europe sont très faibles pour l'alimentation humaine : à peine 500 tonnes en 2019.
En réalité, le principal débouché des protéines d'insectes est le marché de l'alimentation animale avec une production en 2022 d'un peu moins de 10 000 tonnes, dont la moitié sont à destination de l'aquaculture et des animaux domestiques (pet food).
L'élevage d'insectes sert donc principalement à produire des farines en remplacement de celles issues de poissons et des tourteaux de soja dans la nourriture animale. S'il est éventuellement question du remplacement de la viande dans l'alimentation humaine, ce n'est pas le coeur de cible du secteur.
L'étude du Parlement européen table sur une production en forte hausse, avançant le chiffre de 260 000 tonnes d'insectes en 2030. Elle indique que « le potentiel futur des insectes comme aliment devrait être bien supérieur à celui des aliments pour animaux. Une étude des sources alternatives de protéines suggère que, selon l'espèce de poisson, la farine de poisson dans les aliments aquacoles peut être partiellement remplacée par 25 à 30 % de farine d'insectes ; pour le saumon de l'Atlantique, ce remplacement peut même atteindre 100 % sans compromettre la qualité. Pour les porcs et la volaille, 10 % des protéines conventionnelles peuvent être remplacées par de la farine d'insectes. La production d'aliments à base d'insectes devrait ainsi croître d'au moins 2,7 millions de tonnes d'ici 2030. Durant cette période, la part des insectes destinés à l'aquaculture et à l'alimentation animale devrait augmenter, passant de 50 % actuellement à plus de 80 % de la production européenne d'insectes destinés à l'alimentation animale. » La production d'insectes serait donc très dépendante du développement de fermes aquacoles, qui remplaceraient les farines de poisson par des farines d'insectes.
(2) Une filière encore fragile
La viabilité du développement des protéines d'insectes en alimentation animale par rapport aux autres sources de protéines dépend cependant de paramètres économiques.
En particulier, le remplacement de farines de poissons par des farines d'insectes dans les élevages aquacoles ne se fera que si le coût de production des insectes baisse. En effet, le prix de la farine d'insectes est aujourd'hui de 1 500 à 1 800 euros par tonne, là où la farine de poisson s'échange entre 1 000 et 1 200 euros par tonne.
Fondée en 2011 pour valoriser le ténébrion meunier jaune, la start-up française •nsect a mobilisé des financements privés et a bénéficié du soutien de BPIFrance et du programme d'investissements d'avenir (PIA). Son objectif est de développer la production d'insectes pour les animaux de compagnie et de s'attaquer au marché de l'alimentation humaine. La mise à l'échelle industrielle se révèle cependant délicate. L'entreprise doit encore surmonter des obstacles pour atteindre une production rentable. Face à ces difficultés, •nsect a été placée en procédure de sauvegarde en septembre 2024, puis en redressement judiciaire en mars 2025. Elle se concentre sur le marché des aliments pour animaux de compagnie, plus rémunérateur.
Fondée en 2016, la société Innovafeed a choisi plutôt de valoriser la mouche soldat noire, dont la croissance est rapide et les débouchés sont en alimentation animale. La valorisation des coproduits agricoles locaux pour nourrir les insectes et l'utilisation de la chaleur résiduelle d'installations industrielles voisines fait de la production d'insectes une sorte de coproduit industriel.
4. Les algues
a) Les macro-algues
(1) Panorama de la production et de la consommation d'algues
Les algues sont des organismes aquatiques qui se développent par photosynthèse dans l'eau, en utilisant le dioxyde de carbone et les sels minéraux de leur milieu, ainsi que l'eau et la lumière.
Les algues ont d'abord été utilisées à des fins de phytothérapie. Mais, historiquement, elles ont aussi fait l'objet d'une consommation alimentaire dans les espaces côtiers, notamment au Japon.
Selon le Centre d'études et de valorisation des algues (Ceva)97(*), qui s'appuie sur les données de la FAO, la production mondiale d'algues, en progression depuis 30 ans, est aujourd'hui de l'ordre de 35 millions de tonnes par an. Elle est réalisée pour moitié en Chine.
La production d'algues en Europe est marginale au regard de la production mondiale : selon la FAO, elle s'élevait à 310 000 tonnes en 2033, dont 60 à 70 000 tonnes en France.
Il existe une très grande diversité d'algues. La principale distinction est entre les macro-algues, qui représentent 99 % du tonnage mondial, et les micro-algues, souvent produites à terre dans des bassins d'algoculture.
En Europe, les algues sont collectées essentiellement à travers des récoltes en mer (pêche embarquée), sur les rives ou par ramassage des algues épaves qui arrivent à terre, contrairement aux pays d'Asie qui pratiquent l'algoculture dans des parcs dédiés.
L'alimentation humaine n'est pas le seul débouché des algues, même si elle en représente environ les trois quarts. Les macro-algues peuvent être consommées sans grande transformation, comme des légumes, mais le sont le plus souvent après transformation. L'industrie agroalimentaire les utilise notamment comme épaississants et comme gélifiants. Les autres utilisations des algues sont dans le domaine de l'alimentation animale, mais aussi en cosmétique, pharmacie, ou comme engrais. Face à la croissance de ces utilisations, l'Europe et la France ne sont pas autosuffisants et doivent importer plus du double des algues qu'elles produisent.
(2) Les avantages nutritionnels des algues
Les algues sont parfois qualifiées de « trésors marins de nutriments ». Elles concentrent des minéraux et oligo-éléments, sont riches en vitamines, notamment la vitamine B12 et en acides gras polyinsaturés à longue chaîne (EPA et DHA).
Une communication de la Commission européenne de 2022 intitulée « vers un secteur des algues de l'UE fort et durable »98(*), résume ainsi leurs nombreuses vertus : « Pauvres en matières grasses et riches en fibres alimentaires, en oligo-éléments et en composés bioactifs, les algues sont souvent présentées comme des aliments sains et peu caloriques ; certaines espèces sont connues pour avoir une teneur particulièrement élevée en protéines. Grâce à leurs composés et propriétés biochimiques, les algues constituent une matière précieuse pour un nombre croissant d'autres applications commerciales, par exemple les aliments pour animaux/poissons et les additifs pour l'alimentation animale. »
La teneur en protéines des algues marines est variable. Les algues brunes disposent d'un contenu protéique restreint (les protéines représentent 5 à 15 % de la matière sèche), mais les algues vertes peuvent monter à 20 % et certaines algues rouges jusqu'à 30 à 40 %, soit des teneurs similaires au soja.
La plupart des algues contiennent tous les acides aminés essentiels et sont une source importante d'acides aminés acides (acide aspartique et acide glutamique).
Cependant, la digestibilité des algues sous leur forme brute n'est pas toujours bonne, nécessitant des phases de transformation pour en tirer le maximum de bénéfices nutritionnels.
La consommation d'algues semble avoir des effets positifs sur la santé, notamment en termes de maladies cardiovasculaires.
Une certaine vigilance doit cependant être observée au regard de leur teneur en iode et de leur capacité à retenir des métaux lourds (du fait que les fibres algales sont des puissants échangeurs de cations) :
- en 2018, un avis de l'Anses99(*) a déconseillé la consommation d'aliments ou compléments alimentaires contenant des algues aux personnes présentant un dysfonctionnement thyroïdien, une cardiopathie, une insuffisance rénale, ou suivant un traitement par un médicament contenant de l'iode ou du lithium, pour ne pas dépasser les doses d'iode quotidiennes ;
- en 2020, un autre avis de l'Anses100(*), sans aller jusqu'à une recommandation quantitative de consommation d'algues, soulignait les risques liés aux teneurs élevées en cadmium des algues, en particulier les algues rouges et brunes.
Si la consommation alimentaire d'algues est globalement bénéfique pour la santé, elle doit donc faire l'objet de mesures de surveillance appropriées.
(3) Des bénéfices de l'algoculture pour l'environnement
Publiée en 2021, une étude de la FAO intitulée « Algues et microalgues : un aperçu pour exploiter leur potentiel dans le développement de l'aquaculture mondiale »101(*) indique que le développement de l'algoculture est susceptible de générer toute une série d'effets environnementaux positifs.
L'étude note d'abord qu'un des avantages de la culture d'algues et micro-algues est la non-compétition sur l'usage des surfaces de culture. La culture d'algues marines ne nécessite pas d'eau douce, de semences ou d'engrais.
Comme les algues extraient leurs nutriments du milieu marin environnant dont elles absorbent le dioxyde de carbone, la photosynthèse des algues permet d'atténuer l'eutrophisation, de traiter les eaux usées, de réduire l'acidification des océans et de séquestrer du carbone.
Les algues destinées à l'alimentation ont globalement un bilan carbone bas. Il existe cependant des coûts énergétiques liés à l'exploitation des algues : aux phases de récolte (carburant des navires) mais aussi de transformation en produits alimentaires consommables ou en ingrédients (séchage, conditionnement).
Enfin, selon la FAO, l'algoculture peut avoir des effets positifs en matière de création d'habitats pour les poissons et autres organismes marins ou encore de protection du littoral contre les fortes vagues.
Elle offre la possibilité de réduire la surpêche en offrant des moyens de subsistance alternatifs aux communautés de pêcheurs et d'amélioration des sols et de réduction potentielle de l'utilisation de pesticides agricoles grâce à des biofertilisants ou des biostimulants à base d'algues.
Les effets positifs sur l'environnement de l'algoculture ne seront maximaux que si des précautions sont prises dans les conditions d'exploitation, notamment pour éviter d'introduire dans les milieux des espèces invasives, au détriment des espères autochtones,
b) Les micro-algues
Le terme de micro-algues désigne des organismes très divers, généralement de petite taille (par exemple, la chlorelle). Ce sont les premiers maillons de la chaîne alimentaire en milieu aquatique. À l'inverse des macro-algues, les micro-algues ne sont pas récoltées en mer ou sur le rivage. Pour pouvoir les exploiter, il faut un processus contrôlé de production en eau douce, marine ou saumâtre, en bassin ou en photobioréacteur.
Selon un rapport du Conseil général de l'alimentation, de l'agriculture et des espaces ruraux (CGAAER) publié en 2022102(*), « les micro-algues offrent potentiellement de grandes possibilités de valorisation mais à ce jour une dizaine d'espèces seulement sont cultivées. Initialement produites pour nourrir les larves de poissons et de coquillages, les micro-algues connaissent d'ores et déjà des applications dans les secteurs de la cosmétique, des compléments alimentaires (huiles riches en acides gras de type oméga-3), de l'alimentation et de la nutrition animale. Toutefois la plupart des marchés sont encore en émergence. » Par ailleurs, les micro-algues ont bien souvent une meilleure digestibilité que les végétaux, car elles sont dépourvues de paroi ligneuse.
La spiruline, qui est une cyanobactérie, est classée parmi les micro-algues. Elle est l'une des principales espèces produites en France depuis le début des années 2000. Comme le note le rapport précité du CGAAER : « L'intérêt alimentaire des spirulines tient à leur composition : 60 à 70 % de protéines (d'où leur utilisation en complémentation pour des enfants dénutris), toutes les vitamines B12, vitamines A, E et K, des acides gras essentiels, 8 acides aminés essentiels et des minéraux. Sous certaines conditions de culture on peut enrichir leur contenu en oligoéléments, par exemple en sélénium. »
La production de spiruline en bassins nécessite assez peu d'eau, mais ne peut se faire que dans un environnement bénéficiant d'ensoleillement.
Par ailleurs, si le bilan environnemental des micro-algues n'est pas facile à établir précisément, il doit intégrer aujourd'hui la consommation d'énergie nécessaire à toutes les étapes : culture, traitement de l'eau, récolte, lavage, pasteurisation et emballage. Une étude présentée lors d'une conférence Algaeurope fin 2021 estimait que pour 1 kg de spiruline sèche produite, on émettait 15 kg de CO2 (soit plus que pour produire 1 kg de tomates)103(*).
Outre les débouchés alimentaires, les micro-algues font l'objet de recherches pour en faire une source de biocarburants ou encore dans la chimie organique. Le potentiel des micro-algues est encore largement à découvrir et à exploiter.
c) Un potentiel de développement de l'usage alimentaire de toutes les catégories d'algues encore inexploité
Le potentiel de développement des algues comme source de protéines dans l'alimentation est identifié au niveau européen comme au niveau français.
Dans sa communication de novembre 2022 précitée, la Commission européenne indique que « les algues marines peuvent potentiellement satisfaire la demande supplémentaire de biomasse de plus de 100 millions de tonnes prévue pour l'alimentation humaine au cours des 20 prochaines années ». L'étude du Parlement européen d'avril 2024 sur les sources alternatives de protéines dans l'alimentation humaine et animale va dans le même sens, en estimant que « les algues pourraient contribuer encore plus que ce que représente la hausse de la demande totale en protéines projetée d'ici 2050 », faisant des algues un levier pouvant couvrir à lui seul la progression de la demande alimentaire mondiale. Cette étude indique en outre que « les algues pourraient potentiellement remplacer jusqu'à un tiers du tourteau de soja dans l'alimentation des porcs et des volailles ».
À l'échelle européenne, le programme-cadre de recherche et d'innovation Horizon Europe, couvrant la période 2021-2027, ainsi que le Fonds européen pour les affaires maritimes et la pêche, soutiennent plusieurs projets visant à développer la production d'algues et à les valoriser, comme le projet Alehoop104(*) visant à récupérer des protéines alimentaires bon marché à partir de la biomasse d'algues et de plantes pour les intégrer dans des denrées alimentaires ou produits pour animaux.
À l'échelle nationale, une feuille de route nationale pour le développement des filières algales françaises a été établie par le Gouvernement début 2024105(*). Elle s'appuie sur les travaux précités du CGAAER et confirme l'ambition de développer la production et la consommation d'algues.
* 81 https://www.vie-publique.fr/rapport/270420-ressource-proteique-en-alimentation-humaine-et-animale
* 82 https://www.academie-technologies.fr/publications/avenir-des-proteines-alternatives/
* 83 https://www.europarl.europa.eu/thinktank/en/document/EPRS_STU(2024)757806
* 84 C'est-à-dire la proportion de chaque « ingrédient » de la recette.
* 85 https://www.fermentationdeprecision.com
* 86 Sych, J. M., Lacroix, C., & Stevens, M. J., « Vitamin B12 - Physiology, Production and Application » dans E. J. Vandamme, & J. L. Revuelta, Industrial Biotechnology of Vitamins, Biopigments, and Antioxidants, 2016 (pp. 129-159), Wiley ; doi:10.1002/9783527681754.ch6
* 87 https://openknowledge.fao.org/items/527bf0bc-8d7e-4fef-8ce0-cad2c3b01a18
* 88 Voir sur ce point les études du think tank « Good Food Institute » : https://gfi.org/science/the-science-of-fermentation/
* 89 https://agriculture.gouv.fr/la-viande-vitro-cultiver-des-cellules-musculaires-destination-alimentaire-analyse-ndeg164
* 90 Aliments cellulaires : être vigilant pour mieux encadrer et maîtriser la technologie, rapport d'information n° 504 (2022-2023) de MM. Olivier Rietmann et Henri Cabanel, déposé le 5 avril 2023.
* 91 Hocquette, J.-F., « La viande in vitro, une voie exploratoire controversée », INRAE, Intervieweur, Janvier 2021. Récupéré sur https://www.inrae.fr/actualites/viande-vitro-voie-exploratoire-controversee
* 92 https://agriculturecellulaire.fr/
* 93 https://openknowledge.fao.org/server/api/core/bitstreams/94739f50-e6ed-40db-ae7c-2dae11a1fdd6/content
* 94 https://www.anses.fr/fr/content/avis-de-l%E2%80%99anses-relatif-%C3%A0-la-valorisation-des-insectes-dans-l%E2%80%99alimentation-et-l%E2%80%99%C3%A9tat-des
* 95 https://www.sciencedirect.com/science/article/pii/S0959652621029978
* 96 https://mutatec.com/accueil/valeurs-et-histoire/
* 97 https://www.ceva-algues.com/
* 98 https://eur-lex.europa.eu/legal-content/FR/TXT/?uri=CELEX:52022DC0592
* 99 https://www.anses.fr/fr/system/files/NUT2017SA0086.pdf
* 100 https://www.anses.fr/fr/system/files/ERCA2017SA0070.pdf
* 101 https://openknowledge.fao.org/items/d86f0b2b-5e22-45a7-bb4a-9be4795a641a
* 102 https://www.vie-publique.fr/rapport/286950-presentation-et-developpement-de-l-algoculture-en-france
* 103 Source : Pr Jeremy Pruvost, laboratoire Gepea, UMR CNRS 6144.
* 104 https://alehoop.eu/
* 105 https://www.mer.gouv.fr/sites/default/files/2024-02/20240227_feuille_de_route_Algues.pdf